第17页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
- 第213页
- 第214页
- 第215页
- 第216页
- 第217页
- 第218页
- 第219页
- 第220页
- 第221页
- 第222页
- 第223页
- 第224页
- 第225页
- 第226页
- 第227页
- 第228页
- 第229页
- 第230页
- 第231页
- 第232页
- 第233页
- 第234页
- 第235页
- 第236页
- 第237页
- 第238页
- 第239页
- 第240页
- 第241页
- 第242页
- 第243页
- 第244页
- 第245页
- 第246页
- 第247页
- 第248页
- 第249页
- 第250页
- 第251页
- 第252页
- 第253页
- 第254页
- 第255页
- 第256页
- 第257页
- 第258页
- 第259页
- 第260页
- 第261页
5. 四种基本反应类型与氧化还原反应的关系
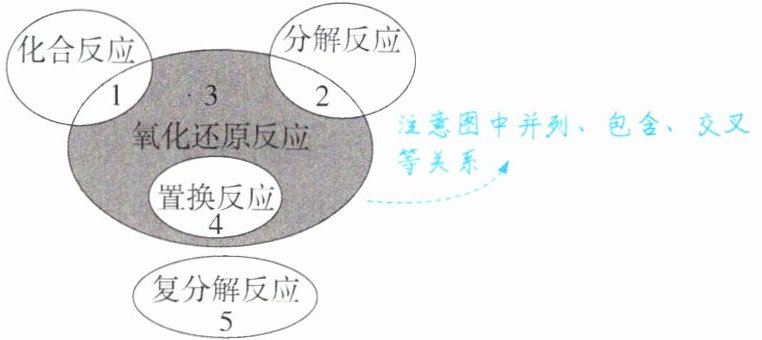
【应用示例】分析下列五个化学反应:
${2Na + 2H_{2}O\xlongequal{}2NaOH + H_{2}\uparrow}$;
${2KClO_{3}\xlongequal[\triangle]{MnO_{2}} 2KCl + 3O_{2}\uparrow}$;
${4NH_{3} + 5O_{2}\xlongequal[\triangle]{催化剂}4NO + 6H_{2}O}$;
${4Fe(OH)_{2} + O_{2} + 2H_{2}O\xlongequal{}4Fe(OH)_{3}}$;
${AgNO_{3} + NaCl\xlongequal{}AgCl\downarrow + NaNO_{3}}$
其中属于“区域1”的是

【应用示例】分析下列五个化学反应:
${2Na + 2H_{2}O\xlongequal{}2NaOH + H_{2}\uparrow}$;
${2KClO_{3}\xlongequal[\triangle]{MnO_{2}} 2KCl + 3O_{2}\uparrow}$;
${4NH_{3} + 5O_{2}\xlongequal[\triangle]{催化剂}4NO + 6H_{2}O}$;
${4Fe(OH)_{2} + O_{2} + 2H_{2}O\xlongequal{}4Fe(OH)_{3}}$;
${AgNO_{3} + NaCl\xlongequal{}AgCl\downarrow + NaNO_{3}}$
其中属于“区域1”的是
④
(填序号,下同),属于“区域2”的是②
,属于“区域3”(阴影部分)的是③
,属于“区域4”的是①
,属于“区域5”的是⑤
。
答案:
应用示例:④ ② ③ ① ⑤
例1(2023·全国乙卷)下列应用中涉及氧化还原反应的是(
A.使用明矾对水进行净化
B.雪天道路上撒盐融雪
C.暖贴中的铁粉遇空气放热
D.荧光指示牌被照发光
C
)A.使用明矾对水进行净化
B.雪天道路上撒盐融雪
C.暖贴中的铁粉遇空气放热
D.荧光指示牌被照发光
答案:
例1 C 解析 明矾净水是由于Al³⁺水解产生的Al(OH)₃胶体具有吸附性,与氧化还原反应无关,A错误;雪天道路撒盐可降低雪的熔点,促进雪融化,与氧化还原反应无关,B错误;暖贴利用了原电池原理,涉及氧化还原反应,C正确;荧光指示牌利用了光的反射原理,与氧化还原反应无关,D错误。
[对点训练1](2024·七省适应性测试安徽化学,1)敦煌壁画是我国灿烂的艺术瑰宝,也是颜料应用的重要科技史料。下列有关我国传统颜料主要成分的变化,发生氧化还原反应的是(
A.骨白${[Ca_{5}(PO_{4})_{3}(OH)]}$遇氟盐转化为${Ca_{5}(PO_{4})_{3}F}$
B.铅白${[2PbCO_{3}\cdot Pb(OH)_{2}]}$遇${H_{2}S}$得到黑色${PbS}$
C.石绿${[CuCO_{3}\cdot Cu(OH)_{2}]}$受热分解得到黑色${CuO}$
D.石黄${(As_{2}S_{3}}$和${As_{4}S_{4})}$在地表逐渐转化为硫酸盐
D
)A.骨白${[Ca_{5}(PO_{4})_{3}(OH)]}$遇氟盐转化为${Ca_{5}(PO_{4})_{3}F}$
B.铅白${[2PbCO_{3}\cdot Pb(OH)_{2}]}$遇${H_{2}S}$得到黑色${PbS}$
C.石绿${[CuCO_{3}\cdot Cu(OH)_{2}]}$受热分解得到黑色${CuO}$
D.石黄${(As_{2}S_{3}}$和${As_{4}S_{4})}$在地表逐渐转化为硫酸盐
答案:
对点训练1 D 解析 Ca₃(PO₄)₂(OH)遇氟盐转化为Ca₅(PO₄)₃F,是难溶电解质之间的转化,发生非氧化还原反应,A不符合题意;铅白遇H₂S得到黑色PbS,各元素化合价均未变化,属于非氧化还原反应,B不符合题意;石绿受热分解得到黑色CuO,各元素化合价均未变化,属于非氧化还原反应,C不符合题意;石黄在地表转化为硫酸盐,S元素由-2价升高到+6价,故发生氧化还原反应,D符合题意。
例2(2023·浙江1月选考)关于反应${2NH_{2}OH + 4Fe^{3+}\xlongequal{}N_{2}O\uparrow + 4Fe^{2+} + 4H^{+} + H_{2}O}$,下列说法正确的是(

A.生成${1mol N_{2}O}$,转移${4mol}$电子
B.${H_{2}O}$是还原产物
C.${NH_{2}OH}$既是氧化剂又是还原剂
D.若设计成原电池,${Fe^{2+}}$为负极产物
A
)
A.生成${1mol N_{2}O}$,转移${4mol}$电子
B.${H_{2}O}$是还原产物
C.${NH_{2}OH}$既是氧化剂又是还原剂
D.若设计成原电池,${Fe^{2+}}$为负极产物
答案:
例2 A 解析 NH₂OH→N₂O,N元素由-1价升高到+1价,故生成1mol N₂O时转移4mol电子,A正确;该反应中,N元素化合价升高,Fe元素化合价降低,故NH₂OH是还原剂,Fe³⁺是氧化剂,B、C错误;原电池中负极发生氧化反应,正极发生还原反应,故设计成原电池时,Fe²⁺是正极还原产物,D错误。
[对点训练2]关于反应${K_{2}H_{3}IO_{6} + 9HI\xlongequal{}2KI + 4I_{2} + 6H_{2}O}$,下列说法错误的是(
A.${K_{2}H_{3}IO_{6}}$发生还原反应,具有氧化性
B.还原剂与氧化剂的物质的量之比为$7:1$
C.${KI}$是还原产物
D.生成${12.7g I_{2}}$时,转移${0.0875mol}$电子
C
)A.${K_{2}H_{3}IO_{6}}$发生还原反应,具有氧化性
B.还原剂与氧化剂的物质的量之比为$7:1$
C.${KI}$是还原产物
D.生成${12.7g I_{2}}$时,转移${0.0875mol}$电子
答案:
对点训练2 C 解析 K₂H₃IO₆中I元素为+7价,得电子被还原为0价I₂,HI中的I元素从-1价升高为0价,发生归中反应,生成4mol I₂时转移7mol e⁻。K₂H₃IO₆发生还原反应,具有氧化性,A正确;9mol HI参与反应,只有7mol HI做还原剂,故还原剂与氧化剂的物质的量之比为7∶1,B正确;KI中K和I元素化合价均未变,故KI既不是氧化产物也不是还原产物,C错误;I₂既是氧化产物又是还原产物,生成4mol I₂转移7mol电子,12.7g I₂为0.05mol,则转移电子为$0.05mol×\frac{7}{4} = 0.0875mol,$D正确。
1. 强弱规律及应用
(1)氧化性和还原性强弱的比较
①依据化学方程式判断
${氧化剂(氧化性) + 还原剂(还原性)\xlongequal{}还原产物(还原性) + 氧化产物(氧化性)}$
氧化性:氧化剂
还原性:还原剂
【应用示例】根据反应${Fe + CuSO_{4}\xlongequal{}Cu + FeSO_{4}}$判断,氧化性:
②根据相同条件下产物中元素价态判断
【应用示例】根据反应:${Fe + S\xlongequal{\triangle}FeS}$ ${2Fe + 3Cl_{2}\xlongequal{\triangle}2FeCl_{3}}$,推测氧化性:${S}$
③根据反应条件及反应剧烈程度判断
一般来说,反应条件要求越低,反应越剧烈,对应物质的氧化性(或还原性)越强。
【应用示例】根据反应:${MnO_{2} + 4HCl(浓)\xlongequal{\triangle}MnCl_{2} + Cl_{2}\uparrow + 2H_{2}O}$,${KClO_{3} + 6HCl(浓)\xlongequal{}KCl + 3Cl_{2}\uparrow + 3H_{2}O}$,判断氧化性:${MnO_{2}}$
(2)强弱规律的应用
同时含有几种氧化剂(或还原剂),发生氧化还原反应时,氧化性(或还原性)强的优先发生反应。简单概括为“强者优先”
【应用示例】在${FeI_{2}}$溶液中通入少量${Cl_{2}}$,由于还原性:
(1)氧化性和还原性强弱的比较
①依据化学方程式判断
${氧化剂(氧化性) + 还原剂(还原性)\xlongequal{}还原产物(还原性) + 氧化产物(氧化性)}$
氧化性:氧化剂
>
氧化产物;还原性:还原剂
>
还原产物。【应用示例】根据反应${Fe + CuSO_{4}\xlongequal{}Cu + FeSO_{4}}$判断,氧化性:
CuSO₄
>FeSO₄
,还原性:Fe
>Cu
。②根据相同条件下产物中元素价态判断
【应用示例】根据反应:${Fe + S\xlongequal{\triangle}FeS}$ ${2Fe + 3Cl_{2}\xlongequal{\triangle}2FeCl_{3}}$,推测氧化性:${S}$
<
${Cl_{2}}$。③根据反应条件及反应剧烈程度判断
一般来说,反应条件要求越低,反应越剧烈,对应物质的氧化性(或还原性)越强。
【应用示例】根据反应:${MnO_{2} + 4HCl(浓)\xlongequal{\triangle}MnCl_{2} + Cl_{2}\uparrow + 2H_{2}O}$,${KClO_{3} + 6HCl(浓)\xlongequal{}KCl + 3Cl_{2}\uparrow + 3H_{2}O}$,判断氧化性:${MnO_{2}}$
<
${KClO_{3}}$。(2)强弱规律的应用
同时含有几种氧化剂(或还原剂),发生氧化还原反应时,氧化性(或还原性)强的优先发生反应。简单概括为“强者优先”
【应用示例】在${FeI_{2}}$溶液中通入少量${Cl_{2}}$,由于还原性:
I⁻
>Fe²⁺
,则I⁻
优先与${Cl_{2}}$反应,离子方程式为Cl₂ + 2I⁻ = 2Cl⁻ + I₂
。
答案:
1.
(1)①> > 应用示例:CuSO₄ FeSO₄ Fe Cu ②应用示例:< ③应用示例:<
(2)应用示例:I⁻ Fe²⁺ I⁻ Cl₂ + 2I⁻ = 2Cl⁻ + I₂
(1)①> > 应用示例:CuSO₄ FeSO₄ Fe Cu ②应用示例:< ③应用示例:<
(2)应用示例:I⁻ Fe²⁺ I⁻ Cl₂ + 2I⁻ = 2Cl⁻ + I₂
查看更多完整答案,请扫码查看


