第12页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
- 第213页
- 第214页
- 第215页
- 第216页
- 第217页
- 第218页
- 第219页
- 第220页
- 第221页
- 第222页
- 第223页
- 第224页
- 第225页
- 第226页
- 第227页
- 第228页
- 第229页
- 第230页
- 第231页
- 第232页
- 第233页
- 第234页
- 第235页
- 第236页
- 第237页
- 第238页
- 第239页
- 第240页
- 第241页
- 第242页
- 第243页
- 第244页
- 第245页
- 第246页
- 第247页
- 第248页
- 第249页
- 第250页
- 第251页
- 第252页
- 第253页
- 第254页
- 第255页
- 第256页
- 第257页
- 第258页
- 第259页
- 第260页
- 第261页
例 1 离子反应在生产、生活中有着广泛的应用,按要求写出下列反应的离子方程式。
(1) 服用小苏打片治疗胃酸过多:________。
(2) 利用食醋去除水壶中的水垢($ CaCO_3 $):
(3) 工业上用足量氨水吸收工业尾气中的 $ SO_2 $:
(1) 服用小苏打片治疗胃酸过多:________。
(2) 利用食醋去除水壶中的水垢($ CaCO_3 $):
2CH₃COOH+CaCO₃=Ca²⁺+2CH₃COO⁻+CO₂↑+H₂O
。(3) 工业上用足量氨水吸收工业尾气中的 $ SO_2 $:
2NH₃·H₂O+SO₂=2NH₄⁺+SO₃²⁻+H₂O
。
答案:
例1 答案(1)HCO₃⁻+H⁺=CO₂↑+H₂O
(2)2CH₃COOH+CaCO₃=Ca²⁺+2CH₃COO⁻+CO₂↑+H₂O
(3)2NH₃·H₂O+SO₂=2NH₄⁺+SO₃²⁻+H₂O
解析(1)胃酸的主要成分是盐酸,小苏打是NaHCO₃,二者反应生成NaCl、CO₂和H₂O。
(2)CH₃COOH的酸性强于H₂CO₃,CH₃COOH与CaCO₃发生反应,书写离子方程式时,只有Ca(CH₃COO)₂拆分成离子。
(3)足量氨水与SO₂反应生成(NH₄)₂SO₃和H₂O,书写离子方程式时,只有(NH₄)₂SO₃拆分成离子形式。
(2)2CH₃COOH+CaCO₃=Ca²⁺+2CH₃COO⁻+CO₂↑+H₂O
(3)2NH₃·H₂O+SO₂=2NH₄⁺+SO₃²⁻+H₂O
解析(1)胃酸的主要成分是盐酸,小苏打是NaHCO₃,二者反应生成NaCl、CO₂和H₂O。
(2)CH₃COOH的酸性强于H₂CO₃,CH₃COOH与CaCO₃发生反应,书写离子方程式时,只有Ca(CH₃COO)₂拆分成离子。
(3)足量氨水与SO₂反应生成(NH₄)₂SO₃和H₂O,书写离子方程式时,只有(NH₄)₂SO₃拆分成离子形式。
对点训练 1
(教材改编题)某同学欲用离子方程式表示两种物质相遇时发生的变化,请你结合相应的实验操作和结果,完成相关离子方程式的书写。
(1) 向稀盐酸中加入碳酸钙:________。
(2) 向 $ Na_2SO_4 $ 溶液中滴加 $ BaCl_2 $ 溶液:________。
(3) 向氢氧化铁悬浊液中滴加稀硝酸:________。
(4) 向 $ NH_4HCO_3 $ 溶液中加入过量 $ NaOH $ 溶液:________。
(教材改编题)某同学欲用离子方程式表示两种物质相遇时发生的变化,请你结合相应的实验操作和结果,完成相关离子方程式的书写。
(1) 向稀盐酸中加入碳酸钙:________。
(2) 向 $ Na_2SO_4 $ 溶液中滴加 $ BaCl_2 $ 溶液:________。
(3) 向氢氧化铁悬浊液中滴加稀硝酸:________。
(4) 向 $ NH_4HCO_3 $ 溶液中加入过量 $ NaOH $ 溶液:________。
答案:
对点训练1 答案(1)CaCO₃+2H⁺=Ca²⁺+CO₂↑+H₂O
(2)Ba²⁺+SO₄²⁻=BaSO₄↓
(3)Fe(OH)₃+3H⁺=Fe³⁺+3H₂O
(4)NH₄⁺+HCO₃⁻+2OH⁻=NH₃·H₂O+CO₃²⁻+H₂O
(2)Ba²⁺+SO₄²⁻=BaSO₄↓
(3)Fe(OH)₃+3H⁺=Fe³⁺+3H₂O
(4)NH₄⁺+HCO₃⁻+2OH⁻=NH₃·H₂O+CO₃²⁻+H₂O
例 2 分析物质的性质,完成下列反应的离子方程式。
(1) $ Ba(OH)_2 $ 溶液与 $ (NH_4)_2SO_4 $ 溶液混合:________。
(2) $ Ca(HCO_3)_2 $ 溶液与少量 $ NaOH $ 溶液混合:
(3) $ CuSO_4 $ 溶液与 $ Ba(OH)_2 $ 溶液混合:________。
(4) $ FeO $ 溶于稀硝酸中:________。
(1) $ Ba(OH)_2 $ 溶液与 $ (NH_4)_2SO_4 $ 溶液混合:________。
(2) $ Ca(HCO_3)_2 $ 溶液与少量 $ NaOH $ 溶液混合:
Ca²⁺+HCO₃⁻+OH⁻=CaCO₃↓+H₂O
。(3) $ CuSO_4 $ 溶液与 $ Ba(OH)_2 $ 溶液混合:________。
(4) $ FeO $ 溶于稀硝酸中:________。
答案:
例2 答案(1)Ba²⁺+2OH⁻+SO₄²⁻+2NH₄⁺=2NH₃·H₂O+BaSO₄↓
(2)Ca²⁺+HCO₃⁻+OH⁻=CaCO₃↓+H₂O
(3)Cu²⁺+SO₄²⁻+Ba²⁺+2OH⁻=BaSO₄↓+Cu(OH)₂↓
(4)3FeO+10H⁺+NO₃⁻=3Fe³⁺+NO↑+5H₂O
解析(1)Ba(OH)₂溶液与(NH₄)₂SO₄溶液混合,Ba²⁺与SO₄²⁻生成BaSO₄沉淀,NH₄⁺与OH⁻结合生成NH₃·H₂O。
(2)Ca(HCO₃)₂溶液与少量NaOH溶液混合,OH⁻结合HCO₃⁻电离产生的H⁺生成H₂O,促进了HCO₃⁻的电离,Ca²⁺与电离产生的CO₃²⁻结合生成CaCO₃沉淀。
(3)CuSO₄溶液与Ba(OH)₂溶液混合,Cu²⁺与OH⁻结合生成Cu(OH)₂沉淀,Ba²⁺与SO₄²⁻结合生成BaSO₄沉淀。
(4)FeO是难溶于水的固体,与稀硝酸发生氧化还原反应生成Fe(NO₃)₃、NO和H₂O。
(2)Ca²⁺+HCO₃⁻+OH⁻=CaCO₃↓+H₂O
(3)Cu²⁺+SO₄²⁻+Ba²⁺+2OH⁻=BaSO₄↓+Cu(OH)₂↓
(4)3FeO+10H⁺+NO₃⁻=3Fe³⁺+NO↑+5H₂O
解析(1)Ba(OH)₂溶液与(NH₄)₂SO₄溶液混合,Ba²⁺与SO₄²⁻生成BaSO₄沉淀,NH₄⁺与OH⁻结合生成NH₃·H₂O。
(2)Ca(HCO₃)₂溶液与少量NaOH溶液混合,OH⁻结合HCO₃⁻电离产生的H⁺生成H₂O,促进了HCO₃⁻的电离,Ca²⁺与电离产生的CO₃²⁻结合生成CaCO₃沉淀。
(3)CuSO₄溶液与Ba(OH)₂溶液混合,Cu²⁺与OH⁻结合生成Cu(OH)₂沉淀,Ba²⁺与SO₄²⁻结合生成BaSO₄沉淀。
(4)FeO是难溶于水的固体,与稀硝酸发生氧化还原反应生成Fe(NO₃)₃、NO和H₂O。
对点训练 2
写出下列反应的离子方程式。
(1) $ Ba(OH)_2 $ 溶液与 $ H_2SO_4 $ 溶液反应:________。
(2) $ NH_4HS $ 溶液与足量 $ NaOH $ 溶液反应:________。
(3) $ Fe_2O_3 $ 溶于 $ HI $ 溶液中:________。
写出下列反应的离子方程式。
(1) $ Ba(OH)_2 $ 溶液与 $ H_2SO_4 $ 溶液反应:________。
(2) $ NH_4HS $ 溶液与足量 $ NaOH $ 溶液反应:________。
(3) $ Fe_2O_3 $ 溶于 $ HI $ 溶液中:________。
答案:
对点训练2 答案(1)Ba²⁺+2OH⁻+2H⁺+SO₄²⁻=BaSO₄↓+2H₂O
(2)NH₄⁺+HS⁻+2OH⁻=NH₃·H₂O+S²⁻+H₂O
(3)Fe₂O₃+6H⁺+2I⁻=2Fe²⁺+3H₂O+I₂
(2)NH₄⁺+HS⁻+2OH⁻=NH₃·H₂O+S²⁻+H₂O
(3)Fe₂O₃+6H⁺+2I⁻=2Fe²⁺+3H₂O+I₂
考向 3 信息型离子方程式的书写
例 3 (1)(2023·天津卷,15 节选)已知:$ Zn + 2NaOH + 2H_2O \xlongequal{} Na_2[Zn(OH)_4] + H_2 \uparrow $。写出氢氧化钠与锌反应的离子方程式:________。
(2)(2023·辽宁卷,16 节选)“氧化”中,用石灰乳调节 $ pH = 4 $,$ Mn^{2+} $ 被 $ H_2SO_5 $ 氧化为 $ MnO_2 $,该反应的离子方程式为________($ H_2SO_5 $ 的电离第一步完全,第二步微弱)。
(3)(2023·湖北卷,18 节选)铜与过量 $ H_2O_2 $ 反应的探究如下:
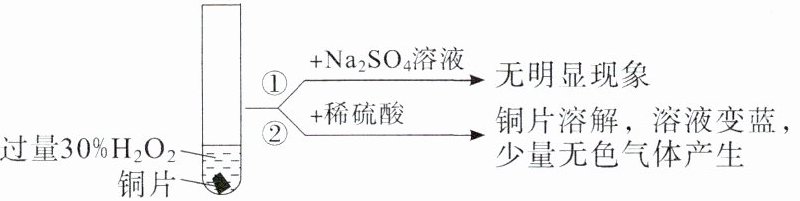
实验中 $ Cu $ 溶解的离子方程式为________。
例 3 (1)(2023·天津卷,15 节选)已知:$ Zn + 2NaOH + 2H_2O \xlongequal{} Na_2[Zn(OH)_4] + H_2 \uparrow $。写出氢氧化钠与锌反应的离子方程式:________。
(2)(2023·辽宁卷,16 节选)“氧化”中,用石灰乳调节 $ pH = 4 $,$ Mn^{2+} $ 被 $ H_2SO_5 $ 氧化为 $ MnO_2 $,该反应的离子方程式为________($ H_2SO_5 $ 的电离第一步完全,第二步微弱)。
(3)(2023·湖北卷,18 节选)铜与过量 $ H_2O_2 $ 反应的探究如下:

实验中 $ Cu $ 溶解的离子方程式为________。
答案:
例3 答案(1)Zn+2OH⁻+2H₂O=[Zn(OH)₄]²⁻+H₂↑
(2)Mn²⁺+HSO₅⁻+H₂O=MnO₂↓+SO₄²⁻+3H⁺
(3)Cu+H₂O₂+2H⁺=Cu²⁺+2H₂O
(2)Mn²⁺+HSO₅⁻+H₂O=MnO₂↓+SO₄²⁻+3H⁺
(3)Cu+H₂O₂+2H⁺=Cu²⁺+2H₂O
对点训练 3
(1)(2022·全国乙卷,26 节选)废旧铅蓄电池的铅膏中主要含有 $ PbSO_4 $、$ PbO_2 $、$ PbO $ 和 $ Pb $,还有少量 $ Ba $、$ Fe $、$ Al $ 的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。

已知 $ PbSO_4 $、$ PbCO_3 $ 的溶度积常数分别为 $ 2.5 × 10^{-8} $、$ 7.4 × 10^{-14} $。
在“脱硫”中 $ PbSO_4 $ 转化反应的离子方程式为________。
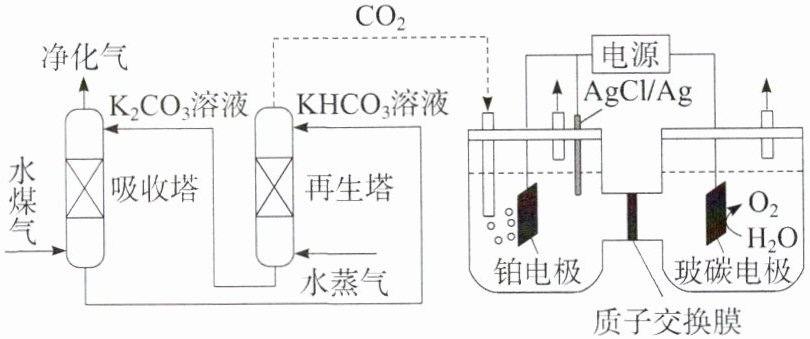
(2)(2022·湖南卷,16 节选)一种脱除和利用水煤气中 $ CO_2 $ 方法的示意图如下:
再生塔中产生 $ CO_2 $ 的离子方程式为________。
(1)(2022·全国乙卷,26 节选)废旧铅蓄电池的铅膏中主要含有 $ PbSO_4 $、$ PbO_2 $、$ PbO $ 和 $ Pb $,还有少量 $ Ba $、$ Fe $、$ Al $ 的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。

已知 $ PbSO_4 $、$ PbCO_3 $ 的溶度积常数分别为 $ 2.5 × 10^{-8} $、$ 7.4 × 10^{-14} $。
在“脱硫”中 $ PbSO_4 $ 转化反应的离子方程式为________。
(2)(2022·湖南卷,16 节选)一种脱除和利用水煤气中 $ CO_2 $ 方法的示意图如下:
再生塔中产生 $ CO_2 $ 的离子方程式为________。

答案:
对点训练3 答案(1)PbSO₄(s)+CO₃²⁻(aq)=PbCO₃(s)+SO₄²⁻(aq)
$(2)2HCO₃⁻\overset{\Delta}{=}CO₃²⁻+H₂O+CO₂↑$
$(2)2HCO₃⁻\overset{\Delta}{=}CO₃²⁻+H₂O+CO₂↑$
查看更多完整答案,请扫码查看


