2025年赢在微点化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年赢在微点化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第170页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
- 第213页
- 第214页
- 第215页
- 第216页
- 第217页
- 第218页
- 第219页
- 第220页
- 第221页
- 第222页
- 第223页
- 第224页
- 第225页
- 第226页
- 第227页
- 第228页
- 第229页
- 第230页
- 第231页
- 第232页
- 第233页
- 第234页
- 第235页
- 第236页
- 第237页
- 第238页
- 第239页
- 第240页
- 第241页
- 第242页
- 第243页
- 第244页
- 第245页
- 第246页
- 第247页
- 第248页
- 第249页
- 第250页
- 第251页
- 第252页
- 第253页
- 第254页
- 第255页
- 第256页
- 第257页
- 第258页
- 第259页
- 第260页
- 第261页
- 第262页
- 第263页
- 第264页
- 第265页
- 第266页
- 第267页
- 第268页
- 第269页
- 第270页
- 第271页
- 第272页
- 第273页
- 第274页
- 第275页
- 第276页
- 第277页
- 第278页
- 第279页
- 第280页
- 第281页
- 第282页
- 第283页
- 第284页
- 第285页
- 第286页
- 第287页
- 第288页
- 第289页
- 第290页
- 第291页
- 第292页
- 第293页
- 第294页
- 第295页
- 第296页
- 第297页
- 第298页
- 第299页
- 第300页
- 第301页
- 第302页
- 第303页
- 第304页
- 第305页
- 第306页
- 第307页
- 第308页
- 第309页
- 第310页
- 第311页
- 第312页
- 第313页
- 第314页
- 第315页
- 第316页
- 第317页
- 第318页
- 第319页
- 第320页
- 第321页
1. (2023·全国甲卷)W、X、Y、Z为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,WX₂是形成酸雨的物质之一。下列说法正确的是( )
A. 原子半径:X>W
B. 简单氢化物的沸点:X<Z
C. Y与X可形成离子化合物
D. Z的最高价含氧酸是弱酸
A. 原子半径:X>W
B. 简单氢化物的沸点:X<Z
C. Y与X可形成离子化合物
D. Z的最高价含氧酸是弱酸
答案:
C 解析 W、X、Y、Z为短周期主族元素,原子序数依次增大,WX₂是形成酸雨的物质之一,根据原子序数的规律,则W为N元素,X为O元素,Y的最外层电子数与其K层电子数相等,又因为Y的原子序数大于氧的,则Y的电子层数为3层,最外层电子数为2,所以Y为Mg元素,四种元素最外层电子数之和为19,则Z的最外层电子数为6,Z为S元素,据此解答。X为O元素,W为N元素,同周期元素从左往右,原子半径依次减小,所以半径W>X,A项错误;X为O元素,Z为S元素,X的简单氢化物为H₂O,含有分子间氢键,Z的简单氢化物为H₂S,没有氢键,所以简单氢化物的沸点X>Z,B项错误;Y为Mg元素,X为O元素,可形成MgO,为离子化合物,C项正确;Z为S元素,硫元素的最高价含氧酸为硫酸,是强酸,D项错误。
2. (2023·全国乙卷)一种矿物由短周期元素W、X、Y组成,溶于稀盐酸有无色无味气体生成。W、X、Y的原子序数依次增大。简单离子X²⁻与Y²⁺具有相同的电子结构。下列叙述正确的是( )
A. X的常见化合价有-1、-2
B. 原子半径大小为Y>X>W
C. YX的水合物具有两性
D. W单质只有4种同素异形体
A. X的常见化合价有-1、-2
B. 原子半径大小为Y>X>W
C. YX的水合物具有两性
D. W单质只有4种同素异形体
答案:
A 解析 W、X、Y为短周期元素,原子序数依次增大,简单离子X²⁻与Y²⁺具有相同的电子结构,则它们均为10电子微粒,X为O元素,Y为Mg元素,W、X、Y组成的物质能溶于稀盐酸,有无色无味的气体产生,则W为C元素,产生的气体为二氧化碳,据此解答。X为O元素,氧元素的常见价态有 - 1价和 - 2价,如H₂O₂和H₂O,A项正确;W为C元素,X为O元素,Y为Mg元素,同主族元素电子层数越多,原子半径越大,元素的电子层数相同时,原子序数越小,原子半径越大,所以原子半径大小为Y>W>X,B项错误;Y为Mg元素,X为O元素,可形成MgO,水合物为Mg(OH)₂,Mg(OH)₂只能与酸反应生成盐和水,不能与碱反应,所以YX的水合物没有两性,C项错误;W为C元素,碳元素的同素异形体有金刚石、石墨、石墨烯、富勒烯、碳纳米管等,种类不止四种,D项错误。
3. (2023·江苏卷)元素C、Si、Ge位于周期表中第ⅣA族。下列说法正确的是( )
A. 原子半径:r(C)>r(Si)>r(Ge)
B. 第一电离能:I₁(C)<I₁(Si)<I₁(Ge)
C. 碳单质、晶体硅、SiC均为共价晶体
D. 可在周期表中Si元素附近寻找新半导体材料
A. 原子半径:r(C)>r(Si)>r(Ge)
B. 第一电离能:I₁(C)<I₁(Si)<I₁(Ge)
C. 碳单质、晶体硅、SiC均为共价晶体
D. 可在周期表中Si元素附近寻找新半导体材料
答案:
D 解析 同主族元素原子半径从上往下逐渐增大,故原子半径r(C)<r(Si)<r(Ge),A项错误;同主族元素,从上往下原子半径增大,更易失电子,第一电离能I₁(C)>I₁(Si)>I₁(Ge),B项错误;晶体硅、SiC均为共价晶体,碳单质中金刚石为共价晶体,而石墨为混合型晶体,C₆₀为分子晶体,C项错误;周期表中Si元素附近存在许多准金属,可在其周围寻找半导体材料,D项正确。
4. (2022·江苏卷)工业上电解熔融Al₂O₃和冰晶石(Na₃AlF₆)的混合物可制得铝。下列说法正确的是( )
A. 半径大小:r(Al³⁺)<r(Na⁺)
B. 电负性大小:x(F)<x(O)
C. 电离能大小:I₁(O)<I₁(Na)
D. 碱性强弱:NaOH<Al(OH)₃
A. 半径大小:r(Al³⁺)<r(Na⁺)
B. 电负性大小:x(F)<x(O)
C. 电离能大小:I₁(O)<I₁(Na)
D. 碱性强弱:NaOH<Al(OH)₃
答案:
A 解析 核外电子排布相同时,核电荷数越大半径越小,故半径大小为r(Al³⁺)<r(Na⁺),A项正确;同周期元素核电荷数越大电负性越大,故x(F)>x(O),B项错误;同周期元素从左往右第一电离能呈增大趋势,同主族元素从上往下第一电离能呈减小趋势,故电离能大小为I₁(O)>I₁(Na),C项错误;元素的金属性越强,其最高价氧化物对应水化物的碱性越强,故碱性NaOH>Al(OH)₃,D项错误。
5. (2022·海南卷)钠和钾是两种常见金属,下列说法正确的是( )
A. 钠元素的第一电离能大于钾元素
B. 基态钾原子的价层电子轨道表示式为[3s↑]
C. 钾能置换出NaCl溶液中的钠
D. 钠元素与钾元素的原子序数相差18
A. 钠元素的第一电离能大于钾元素
B. 基态钾原子的价层电子轨道表示式为[3s↑]
C. 钾能置换出NaCl溶液中的钠
D. 钠元素与钾元素的原子序数相差18
答案:
A 解析 同主族元素的第一电离能从上到下依次减小,金属性越强的元素其第一电离能越小,因此,钠元素的第一电离能大于钾元素,A项正确;基态钾原子的价层电子为4s¹,其轨道表示式为4s↑,B项错误;钾和钠均能与水发生置换反应,因此,钾不能置换出NaCl溶液中的钠,C项错误;钠元素与钾元素的原子序数分别为11和19,两者相差8,D项错误。
6. (2022·全国甲卷)Q、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为19。Q与X、Y、Z位于不同周期,X、Y相邻,Y原子最外层电子数是Q原子内层电子数的2倍。下列说法正确的是( )
A. 非金属性:X>Q
B. 单质的熔点:X>Y
C. 简单氢化物的沸点:Z>Q
D. 最高价含氧酸的酸性:Z>Y
A. 非金属性:X>Q
B. 单质的熔点:X>Y
C. 简单氢化物的沸点:Z>Q
D. 最高价含氧酸的酸性:Z>Y
答案:
D 解析 Q、X、Y、Z为原子序数依次增大的短周期主族元素,Q与X、Y、Z位于不同周期,Y原子最外层电子数为Q原子内层电子数的2倍,则Q应为第二周期元素,X、Y、Z位于第三周期,Y的最外层电子数为4,则Y为Si元素;X、Y相邻,且X的原子序数小于Y,则X为Al元素;Q、X、Y、Z的最外层电子数之和为19,则Q、Z的最外层电子数之和为19 - 3 - 4 = 12,主族元素的最外层电子数最多为7,若Q的最外层电子数为7,为F元素,则Z的最外层电子数为5,为P元素;若Q的最外层电子数为6,为O元素,则Z的最外层电子数为6,为S元素;若Q的最外层电子数为5,为N元素,则Z的最外层电子数为7,为Cl元素。X为Al元素,Q为N或O或F元素,同周期从左往右元素的非金属性依次增强,同主族从上往下元素的非金属性依次减弱,故非金属性Q>X,A项错误;X为Al元素,属于金属晶体,Y为Si元素,属于共价晶体,单质熔点Si>Al,即Y>X,B项错误;Q为N或O或F元素,其简单氢化物为NH₃或H₂O或HF,Z为Cl或S或P元素,其简单氢化物为HCl或H₂S或PH₃,由于前者物质中存在分子间氢键,而后者物质中不存在,故沸点Q>Z,C项错误;元素的非金属性越强,其最高价含氧酸的酸性越强,P、S、Cl的非金属性均强于Si元素,因此最高价含氧酸的酸性Z>Y,D项正确。
7. (2022·湖南卷)科学家合成了一种新的共价化合物(结构如图所示),X、Y、Z、W为原子序数依次增大的短周期元素,W的原子序数等于X与Y的原子序数之和。下列说法错误的是( )
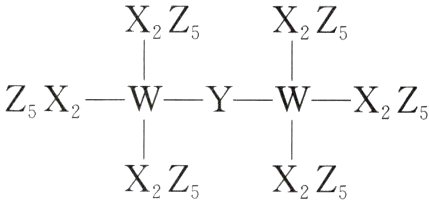
A. 原子半径:X>Y>Z
B. 非金属性:Y>X>W
C. Z的单质具有较强的还原性
D. 原子序数为82的元素与W位于同一主族
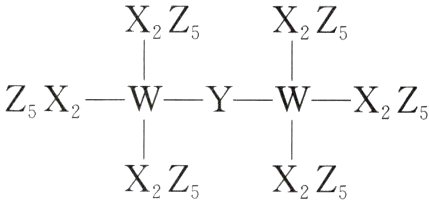
A. 原子半径:X>Y>Z
B. 非金属性:Y>X>W
C. Z的单质具有较强的还原性
D. 原子序数为82的元素与W位于同一主族
答案:
C 解析 由共价化合物的结构可知,X、W形成4个共价键,Y形成2个共价键,Z形成1个共价键,X、Y、Z、W是原子序数依次增大的短周期元素,W的原子序数等于X与Y的原子序数之和,则X为C元素、Y为O元素、Z为F元素、W为Si元素。同周期元素,从左到右原子半径依次减小,则C、O、F的原子半径大小顺序为C>O>F,A项正确;同周期元素,从左到右元素的非金属性依次增强,同主族元素,从上到下元素的非金属性依次减弱,则C、O、Si的非金属性强弱顺序为O>C>Si,B项正确;位于元素周期表右上角的氟元素的非金属性最强,其单质具有很强的氧化性,C项错误;原子序数为82的元素为铅元素,与硅元素都位于元素周期表第ⅣA族,D项正确。
8. (2022·广东卷)甲~戊均为短周期元素,在元素周期表中的相对位置如图所示;戊的最高价氧化物对应的水化物为强酸。下列说法不正确的是( )
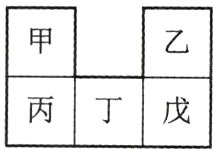
A. 原子半径:丁>戊>乙
B. 非金属性:戊>丁>丙
C. 甲的氢化物遇氯化氢一定有白烟产生
D. 丙的最高价氧化物对应的水化物一定能与强碱反应

A. 原子半径:丁>戊>乙
B. 非金属性:戊>丁>丙
C. 甲的氢化物遇氯化氢一定有白烟产生
D. 丙的最高价氧化物对应的水化物一定能与强碱反应
答案:
C 解析 甲~戊是短周期元素,戊的最高价氧化物对应水化物为强酸,则可能是硫酸或高氯酸,若是高氯酸,则戊为Cl元素,甲为N元素、乙为F元素、丙为P元素、丁为S元素;若是硫酸,则戊为S元素,甲为C元素、乙为O元素、丙为Si元素、丁为P元素。根据层多径大,同电子层结构序大径小原则,则原子半径丁>戊>乙,A项正确。根据同周期元素从左到右非金属性逐渐增强,则非金属性戊>丁>丙,B项正确。甲的氢化物可能为氨气,也可能为甲烷、乙烷等,若是氨气,则遇氯化氢一定有白烟产生;若是甲烷、乙烷等,则遇氯化氢不反应,没有白烟生成,C项错误。丙的最高价氧化物对应的水化物可能是硅酸,也可能是磷酸,都能与强碱反应,D项正确。
查看更多完整答案,请扫码查看


