2025年赢在微点化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年赢在微点化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第101页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
- 第213页
- 第214页
- 第215页
- 第216页
- 第217页
- 第218页
- 第219页
- 第220页
- 第221页
- 第222页
- 第223页
- 第224页
- 第225页
- 第226页
- 第227页
- 第228页
- 第229页
- 第230页
- 第231页
- 第232页
- 第233页
- 第234页
- 第235页
- 第236页
- 第237页
- 第238页
- 第239页
- 第240页
- 第241页
- 第242页
- 第243页
- 第244页
- 第245页
- 第246页
- 第247页
- 第248页
- 第249页
- 第250页
- 第251页
- 第252页
- 第253页
- 第254页
- 第255页
- 第256页
- 第257页
- 第258页
- 第259页
- 第260页
- 第261页
- 第262页
- 第263页
- 第264页
- 第265页
- 第266页
- 第267页
- 第268页
- 第269页
- 第270页
- 第271页
- 第272页
- 第273页
- 第274页
- 第275页
- 第276页
- 第277页
- 第278页
- 第279页
- 第280页
- 第281页
- 第282页
- 第283页
- 第284页
- 第285页
- 第286页
- 第287页
- 第288页
- 第289页
- 第290页
- 第291页
- 第292页
- 第293页
- 第294页
- 第295页
- 第296页
- 第297页
- 第298页
- 第299页
- 第300页
- 第301页
- 第302页
- 第303页
- 第304页
- 第305页
- 第306页
- 第307页
- 第308页
- 第309页
- 第310页
- 第311页
- 第312页
- 第313页
- 第314页
- 第315页
- 第316页
- 第317页
- 第318页
- 第319页
- 第320页
- 第321页
思维辨析
判断正误,正确的画“√”,错误的画“×”。
1. 从海带中提取碘的过程中,可以用酸化的H$_{2}$O$_{2}$将溶液中的I$^{-}$氧化成I$_{2}$。( )
2. 海水蒸馏装置中冷却水的流向上进下出。( )
3. 电解氯化钠、氯化镁的水溶液可以制得钠和镁。( )
4. 理想的原子经济性的合成反应是原料分子中的原子百分之百转变成产物。( )
5. 提取海水中的镁、钾、溴、碘等化工产品需要解决物质的富集问题。( )
判断正误,正确的画“√”,错误的画“×”。
1. 从海带中提取碘的过程中,可以用酸化的H$_{2}$O$_{2}$将溶液中的I$^{-}$氧化成I$_{2}$。( )
2. 海水蒸馏装置中冷却水的流向上进下出。( )
3. 电解氯化钠、氯化镁的水溶液可以制得钠和镁。( )
4. 理想的原子经济性的合成反应是原料分子中的原子百分之百转变成产物。( )
5. 提取海水中的镁、钾、溴、碘等化工产品需要解决物质的富集问题。( )
答案:
1. √ 提示:发生反应2I⁻ + H₂O₂ + 2H⁺ = I₂ + 2H₂O,产物无污染、易分离。
2. × 提示:海水蒸馏装置中冷却水的流向是下进上出,目的是保证冷凝管中充满冷却水,冷却效果更好,冷凝水的利用效率更高。
3. × 提示:钠、镁的冶炼是通过电解熔融盐(氯化物)来完成的。
4. √ 提示:理想的原子经济性的合成反应应该是原料分子中的原子百分之百地转变成产物。
5. √ 提示:海水中含有的各种元素的特点是种类多、总储量大、富集程度低。因此,从海水中提取物质需要解决物质的富集问题。
2. × 提示:海水蒸馏装置中冷却水的流向是下进上出,目的是保证冷凝管中充满冷却水,冷却效果更好,冷凝水的利用效率更高。
3. × 提示:钠、镁的冶炼是通过电解熔融盐(氯化物)来完成的。
4. √ 提示:理想的原子经济性的合成反应应该是原料分子中的原子百分之百地转变成产物。
5. √ 提示:海水中含有的各种元素的特点是种类多、总储量大、富集程度低。因此,从海水中提取物质需要解决物质的富集问题。
5. 从海水中提取镁,正确的方法是( )
A. 海水$\xrightarrow{NaOH}$Mg(OH)$_{2}$$\xrightarrow{电解}$Mg
B. 海水$\xrightarrow{HCl}$MgCl$_{2}$溶液$\longrightarrow$MgCl$_{2}$晶体$\xrightarrow{电解}$Mg
C. 海水$\xrightarrow{石灰乳}$Mg(OH)$_{2}$$\xrightarrow{灼烧}$MgO$\xrightarrow{电解}$Mg
D. 海水$\xrightarrow[过滤]{石灰乳}$Mg(OH)$_{2}$$\xrightarrow{HCl}$MgCl$_{2}$溶液$\xrightarrow[过滤]{结晶}$MgCl$_{2}$·6H$_{2}$O$\xrightarrow[\triangle]{HCl}$MgCl$_{2}$(熔融)$\xrightarrow{电解}$Mg
A. 海水$\xrightarrow{NaOH}$Mg(OH)$_{2}$$\xrightarrow{电解}$Mg
B. 海水$\xrightarrow{HCl}$MgCl$_{2}$溶液$\longrightarrow$MgCl$_{2}$晶体$\xrightarrow{电解}$Mg
C. 海水$\xrightarrow{石灰乳}$Mg(OH)$_{2}$$\xrightarrow{灼烧}$MgO$\xrightarrow{电解}$Mg
D. 海水$\xrightarrow[过滤]{石灰乳}$Mg(OH)$_{2}$$\xrightarrow{HCl}$MgCl$_{2}$溶液$\xrightarrow[过滤]{结晶}$MgCl$_{2}$·6H$_{2}$O$\xrightarrow[\triangle]{HCl}$MgCl$_{2}$(熔融)$\xrightarrow{电解}$Mg
答案:
D 解析 从海水中提取镁时,首先用石灰乳将海水中的Mg²⁺沉淀出来,然后再用盐酸将其溶解得到MgCl₂溶液,从MgCl₂溶液中冷却结晶得到MgCl₂·6H₂O,在HCl气流中加热MgCl₂·6H₂O得到无水MgCl₂,最后电解熔融MgCl₂得到单质Mg。
7. 从海带中提取I$_{2}$的实验中,所选择的装置或仪器(夹持装置已略去)正确的是( )
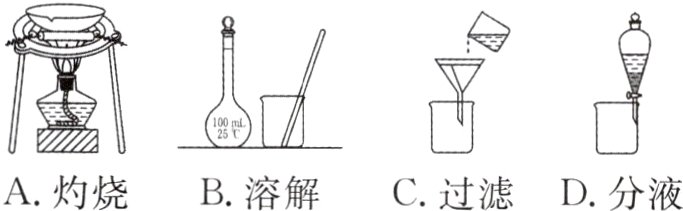

答案:
D 解析 灼烧海带时应该使用坩埚,A项错误;容量瓶用于定容,不用于溶解,B项错误;过滤操作缺少玻璃棒,且漏斗下端未紧贴烧杯内壁,C项错误;分液时需要使用分液漏斗,漏斗下口紧靠烧杯内壁,D项正确。
8. 溴主要以Br$^{-}$形式存在于海水中,海水呈弱碱性。工业上制备Br$_{2}$的操作步骤为
①一定条件下,将Cl$_{2}$通入浓缩的海水中生成Br$_{2}$;
②利用热空气将Br$_{2}$吹出,并用浓Na$_{2}$CO$_{3}$溶液吸收,生成NaBr、NaBrO$_{3}$等;
③用硫酸酸化步骤②得到的混合物。
回答下列问题:
(1)Cl$_{2}$氧化Br$^{-}$应在 ____ 条件下进行,目的是避免 ____ 。
(2)Br$_{2}$可用热空气吹出,其原因是 ____ 。
(3)写出步骤③所发生反应的化学方程式: ____ 。用硫酸而不用盐酸酸化的原因可能是 ____ 。步骤②的产品有时运输到目的地后再酸化,主要是因为 ____ 。
①一定条件下,将Cl$_{2}$通入浓缩的海水中生成Br$_{2}$;
②利用热空气将Br$_{2}$吹出,并用浓Na$_{2}$CO$_{3}$溶液吸收,生成NaBr、NaBrO$_{3}$等;
③用硫酸酸化步骤②得到的混合物。
回答下列问题:
(1)Cl$_{2}$氧化Br$^{-}$应在 ____ 条件下进行,目的是避免 ____ 。
(2)Br$_{2}$可用热空气吹出,其原因是 ____ 。
(3)写出步骤③所发生反应的化学方程式: ____ 。用硫酸而不用盐酸酸化的原因可能是 ____ 。步骤②的产品有时运输到目的地后再酸化,主要是因为 ____ 。
答案:
答案
(1)酸性 氯气与碱发生歧化反应
(2)Br₂易挥发
(3)5NaBr + NaBrO₃ + 3H₂SO₄ = 3Br₂ + 3Na₂SO₄ + 3H₂O 防止在酸性条件下,溴酸钠将Cl⁻氧化为氯气,影响生成溴的纯度 溴具有强氧化性(或强腐蚀性)
解析
(1)存在Br⁻的海水呈弱碱性,在碱性条件下Cl₂及生成的Br₂易发生歧化反应,故Cl₂氧化Br⁻应在酸性条件下进行。
(2)因溴沸点低、易挥发,故可用热空气吹出。
(3)发生归中反应生成硫酸钠、溴单质和水;盐酸能被溴酸钠氧化,故不能利用盐酸酸化。
(1)酸性 氯气与碱发生歧化反应
(2)Br₂易挥发
(3)5NaBr + NaBrO₃ + 3H₂SO₄ = 3Br₂ + 3Na₂SO₄ + 3H₂O 防止在酸性条件下,溴酸钠将Cl⁻氧化为氯气,影响生成溴的纯度 溴具有强氧化性(或强腐蚀性)
解析
(1)存在Br⁻的海水呈弱碱性,在碱性条件下Cl₂及生成的Br₂易发生歧化反应,故Cl₂氧化Br⁻应在酸性条件下进行。
(2)因溴沸点低、易挥发,故可用热空气吹出。
(3)发生归中反应生成硫酸钠、溴单质和水;盐酸能被溴酸钠氧化,故不能利用盐酸酸化。
查看更多完整答案,请扫码查看


