2025年红对勾高考一轮复习金卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年红对勾高考一轮复习金卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第182页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
- 第213页
- 第214页
- 第215页
- 第216页
- 第217页
- 第218页
- 第219页
- 第220页
- 第221页
- 第222页
- 第223页
- 第224页
- 第225页
- 第226页
- 第227页
- 第228页
- 第229页
- 第230页
- 第231页
- 第232页
- 第233页
- 第234页
- 第235页
- 第236页
- 第237页
- 第238页
- 第239页
- 第240页
- 第241页
- 第242页
- 第243页
- 第244页
- 第245页
6.(2024·陕西咸阳模拟)常温下,浓度均为0.1 mol·L⁻¹的下列溶液中,粒子的物质的量浓度关系正确的是 ( )
A.氨水中,$c(NH_{4}^{+}) = c(OH^{-}) = 0.1 mol·L^{-1}$
B.NH₄Cl溶液中,$c(NH_{4}^{+})>c(Cl^{-})$
C.Na₂SO₄溶液中,$c(Na^{+})>c(SO_{4}^{2 - })>c(OH^{-}) = c(H^{+})$
D.Na₂SO₃溶液中,$c(Na^{+}) = 2c(SO_{3}^{2 - }) + c(HSO_{3}^{-}) + c(H₂SO₃)$
A.氨水中,$c(NH_{4}^{+}) = c(OH^{-}) = 0.1 mol·L^{-1}$
B.NH₄Cl溶液中,$c(NH_{4}^{+})>c(Cl^{-})$
C.Na₂SO₄溶液中,$c(Na^{+})>c(SO_{4}^{2 - })>c(OH^{-}) = c(H^{+})$
D.Na₂SO₃溶液中,$c(Na^{+}) = 2c(SO_{3}^{2 - }) + c(HSO_{3}^{-}) + c(H₂SO₃)$
答案:
氨水为弱碱溶液,只能部分电离出OH⁻,结合电荷守恒c(NH₄⁺)+c(H⁺)=c(OH⁻),可得c(NH₄⁺)<c(OH⁻)<0.1mol·L⁻¹,A错误;NH₄Cl溶液中,NH₄⁺部分水解,Cl⁻浓度不变,则溶液中:c(NH₄⁺)<c(Cl⁻),B错误;Na₂SO₄溶液显中性,c(OH⁻)=c(H⁺),结合电荷守恒可得c(Na⁺)=2c(SO₄²⁻),溶液中离子浓度大小为c(Na⁺)>c(SO₄²⁻)>c(OH⁻)=c(H⁺),C正确;根据Na₂SO₃溶液中的元素守恒可得c(Na⁺)=2c(SO₃²⁻)+2c(HSO₃⁻)+2c(H₂SO₃),D错误。
7.(2025·浙江宁波期末)在干燥的HCl气流中加热MgCl₂·6H₂O,能得到无水MgCl₂。下列说法正确的是 ( )
A.$MgCl_{2}·nH₂O(s) = MgCl_{2}·(n - 1)H₂O(s) + H₂O(g)$ $\Delta H<0$
B.$MgCl_{2}·2H₂O(s) ⇌ Mg(OH)₂(s) + 2HCl(g)$,HCl气流可促进反应进行
C.$MgCl_{2}·H₂O(s) ⇌ Mg(OH)Cl(s) + HCl(g)$,升高温度,反应更易发生
D.$MgCl_{2}·4H₂O(s) ⇌ MgCl_{2}·2H₂O(s) + 2H₂O(g)$,HCl气流可抑制反应进行
A.$MgCl_{2}·nH₂O(s) = MgCl_{2}·(n - 1)H₂O(s) + H₂O(g)$ $\Delta H<0$
B.$MgCl_{2}·2H₂O(s) ⇌ Mg(OH)₂(s) + 2HCl(g)$,HCl气流可促进反应进行
C.$MgCl_{2}·H₂O(s) ⇌ Mg(OH)Cl(s) + HCl(g)$,升高温度,反应更易发生
D.$MgCl_{2}·4H₂O(s) ⇌ MgCl_{2}·2H₂O(s) + 2H₂O(g)$,HCl气流可抑制反应进行
答案:
MgCl₂·nH₂O(s)=MgCl₂·(n - 1)H₂O(s)+H₂O(g)属于分解反应,分解反应大多是吸热反应,所以反应△H>0,A错误;MgCl₂水解会生成HCl,HCl气流可抑制水解反应进行,B错误;盐类的水解反应是吸热反应,加热促进水解反应的进行,升高温度,MgCl₂·H₂O(s)⇌Mg(OH)Cl(s)+HCl(g)更易发生,C正确;MgCl₂·4H₂O(s)⇌MgCl₂·2H₂O(s)+2H₂O(g),该反应产物中没有HCl,HCl气流不能抑制反应进行,D错误。
8.安息香酸(HR)是最简单的一元芳香酸,其钠盐(用NaR表示)的水溶液呈碱性。已知常温下,$K_{a}(HR)>K_{a1}(H₂CO₃)$。下列说法正确的是 ( )
A.常温下,0.001 mol·L⁻¹ HR水溶液的pH = 3
B.向NaR水溶液中加水稀释,溶液的pH升高
C.NaR水溶液中,$c(HR) + c(H^{+}) = c(R^{-}) + c(OH^{-})$
D.常温下,NaR溶液的碱性比同浓度的NaHCO₃溶液弱
A.常温下,0.001 mol·L⁻¹ HR水溶液的pH = 3
B.向NaR水溶液中加水稀释,溶液的pH升高
C.NaR水溶液中,$c(HR) + c(H^{+}) = c(R^{-}) + c(OH^{-})$
D.常温下,NaR溶液的碱性比同浓度的NaHCO₃溶液弱
答案:
由题意,HR是有机酸,是弱酸,不完全电离,常温下,0.001mol·L⁻¹HR水溶液的pH>3,A错误;NaR水溶液由于R⁻水解显碱性,加水稀释水解程度变大,但是碱性变弱,溶液的pH减小,B错误;NaR水溶液中的质子守恒为c(HR)+c(H⁺)=c(OH⁻),C错误;由已知,Kₐ(HR)>Kₐ₁(H₂CO₃),HR酸性比碳酸强,根据越弱越水解,同浓度的NaHCO₃溶液水解程度大,碱性强,故NaR溶液的碱性更弱,D正确。
9.(2024·四川绵阳质检)25 ℃时,在10 mL浓度均为0.1 mol·L⁻¹的NaOH和NH₃·H₂O混合溶液中滴加0.1 mol·L⁻¹的盐酸。下列有关溶液中粒子浓度关系正确的是 ( )
A.未加盐酸时:$c(OH^{-})>c(Na^{+}) = c(NH₃·H₂O)$
B.加入10 mL盐酸时:$c(NH_{4}^{+}) + c(H^{+}) = c(OH^{-})$
C.加入盐酸至溶液pH = 7时:$c(Cl^{-}) = c(Na^{+})$
D.加入20 mL盐酸时:$c(Cl^{-}) = c(NH_{4}^{+}) + c(Na^{+})$
A.未加盐酸时:$c(OH^{-})>c(Na^{+}) = c(NH₃·H₂O)$
B.加入10 mL盐酸时:$c(NH_{4}^{+}) + c(H^{+}) = c(OH^{-})$
C.加入盐酸至溶液pH = 7时:$c(Cl^{-}) = c(Na^{+})$
D.加入20 mL盐酸时:$c(Cl^{-}) = c(NH_{4}^{+}) + c(Na^{+})$
答案:
NH₃·H₂O是弱电解质,能部分电离,溶液中c(Na⁺)>c(NH₃·H₂O),A错误;当加入10mL盐酸时,恰好将NaOH 中和完,溶液中c(Na⁺)=c(Cl⁻),根据电荷守恒c(Na⁺)+c(NH₄⁺)+c(H⁺)=c(Cl⁻)+c(OH⁻)可知,c(NH₄⁺)+c(H⁺)=c(OH⁻),B正确;溶液pH=7时,溶液中c(H⁺)=c(OH⁻),根据电荷守恒c(Na⁺)+c(NH₄⁺)=c(Cl⁻),C错误;加入20mL盐酸时,恰好将NaOH和NH₃·H₂O中和完,根据元素守恒c(Na⁺)+c(NH₄⁺)+c(NH₃·H₂O)=c(Cl⁻),D错误。
10.(2025·山东青岛期中)某实验测得0.1 mol·L⁻¹ NaHCO₃溶液在升温过程中(不考虑水挥发)的pH变化曲线如图,下列说法错误的是 ( )
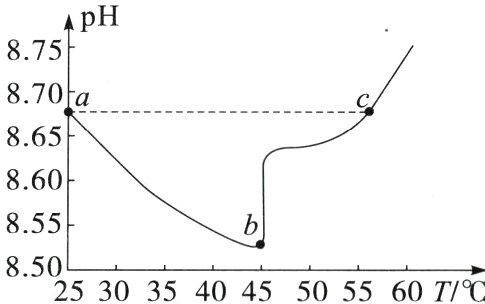
A.溶液的$c(OH^{-})$:a点 < c点
B.a点时,$K_{w}<K_{a1}(H₂CO₃)·K_{a2}(H₂CO₃)$
C.b点溶液中,$c(Na^{+})>c(HCO_{3}^{-}) + 2c(CO_{3}^{2 - })$
D.虽然ab段pH减小,但是升温仍然促进了$HCO_{3}^{-}$的水解

A.溶液的$c(OH^{-})$:a点 < c点
B.a点时,$K_{w}<K_{a1}(H₂CO₃)·K_{a2}(H₂CO₃)$
C.b点溶液中,$c(Na^{+})>c(HCO_{3}^{-}) + 2c(CO_{3}^{2 - })$
D.虽然ab段pH减小,但是升温仍然促进了$HCO_{3}^{-}$的水解
答案:
碳酸氢钠在溶液中存在电离趋势和水解趋势,升高温度,ab段电离平衡和水解平衡均右移,温度对电离平衡的影响大于对水解平衡的影响,所以溶液pH减小,bc段可能温度对电离平衡的影响小于对水解平衡的影响,也可能NaHCO₃逐渐受热分解为Na₂CO₃,所以溶液pH增大。由图可知,a点和c点溶液pH相同,溶液中氢离子浓度相等,温度升高,水的离子积常数增大,则c点溶液中氢氧根离子的浓度大于a点,故A正确;由图可知,a点时碳酸氢钠溶液呈碱性,说明碳酸氢根离子在溶液中的水解程度大于电离程度,则碳酸氢根离子的电离常数小于水解常数,Kₐ₂(H₂CO₃)<Kₕ=$\frac{K_w}{Kₐ₁(H₂CO₃)}$,所以K_w>Kₐ₂(H₂CO₃)×Kₐ₁(H₂CO₃),故B错误;由图可知,b点溶液呈碱性,由电荷守恒c(Na⁺)+c(H⁺)=c(HCO₃⁻)+2c(CO₃²⁻)+c(OH⁻)可知,溶液中c(Na⁺)>c(HCO₃⁻)+2c(CO₃²⁻),故C正确;由分析可知,升高温度,ab段促进了碳酸氢根离子的电离,同时也促进了碳酸氢根离子的水解,故D 正确。
查看更多完整答案,请扫码查看


