2025年红对勾高考一轮复习金卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年红对勾高考一轮复习金卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第11页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
- 第213页
- 第214页
- 第215页
- 第216页
- 第217页
- 第218页
- 第219页
- 第220页
- 第221页
- 第222页
- 第223页
- 第224页
- 第225页
- 第226页
- 第227页
- 第228页
- 第229页
- 第230页
- 第231页
- 第232页
- 第233页
- 第234页
- 第235页
- 第236页
- 第237页
- 第238页
- 第239页
- 第240页
- 第241页
- 第242页
- 第243页
- 第244页
- 第245页
17.(2024·山东济南模拟)$CuI$是难溶于水的白色固体。已知:氧化性:$Cu^{2+}>I_{2}>Cu^{+}$,还原性:$Cu>I^{-}>Cu^{+}$。
(1)根据物质氧化性和还原性的强弱推测,在溶液中$Cu^{2+}$和$I^{-}$反应的产物是________________。
(2)久置于空气中的$HI$溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,反应的化学方程式为__________________________。
(3)欲消除(2)中$HI$溶液的黄色,也可向其中通入少量$H_{2}S$,这是因为当浓度接近时,还原性:$H_{2}S$________(填“>”“<”或“=”)
$I^{-}$;与加入铜粉的方法相比,用此方法得到的$HI$溶液浓度________(填“高”“低”或“相等”)。
(4)$CuI$可用于监测空气中是否含有汞蒸气:$4CuI(白色)+Hg = Cu_{2}HgI_{4}(亮黄色)+2Cu$。下列关于该化学方程式的说法错误的是________(填字母)。
A.该反应中被氧化的元素是铜元素和汞元素
B.该反应的氧化剂为$CuI$
C.$Cu_{2}HgI_{4}$既是氧化产物又是还原产物
D.反应中每生成$1molCu_{2}HgI_{4}$转移$2mol$电子
(1)根据物质氧化性和还原性的强弱推测,在溶液中$Cu^{2+}$和$I^{-}$反应的产物是________________。
(2)久置于空气中的$HI$溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,反应的化学方程式为__________________________。
(3)欲消除(2)中$HI$溶液的黄色,也可向其中通入少量$H_{2}S$,这是因为当浓度接近时,还原性:$H_{2}S$________(填“>”“<”或“=”)
$I^{-}$;与加入铜粉的方法相比,用此方法得到的$HI$溶液浓度________(填“高”“低”或“相等”)。
(4)$CuI$可用于监测空气中是否含有汞蒸气:$4CuI(白色)+Hg = Cu_{2}HgI_{4}(亮黄色)+2Cu$。下列关于该化学方程式的说法错误的是________(填字母)。
A.该反应中被氧化的元素是铜元素和汞元素
B.该反应的氧化剂为$CuI$
C.$Cu_{2}HgI_{4}$既是氧化产物又是还原产物
D.反应中每生成$1molCu_{2}HgI_{4}$转移$2mol$电子
答案:
(1)CuI I₂
(2)2Cu + I₂ = 2CuI
(3)> 高
(4)AC
解析:
(1)氧化性:Cu²⁺>I₂>Cu⁺,还原性:Cu>I⁻>Cu⁺,所以Cu²⁺和I⁻反应,Cu²⁺被还原为Cu⁺,I⁻被氧化为I₂,Cu⁺和I⁻结合生成难溶于水的CuI沉淀,所以反应的产物是CuI、I₂。
(2)久置于空气中的HI溶液呈黄色,是因为其中的碘离子被空气中的O₂氧化为碘单质,加入金属铜,金属铜可以和碘单质反应生成CuI,反应的化学方程式为2Cu + I₂ = 2CuI。
(3)欲消除HI溶液的黄色,也可向其中通入少量H₂S,当浓度接近时,碘单质可以和硫化氢反应生成单质硫和碘化氢,还原性:H₂S>I⁻。
(4)该反应中铜元素化合价由+1降低为0,汞元素化合价由0升高为+2,被氧化的元素是汞元素,氧化剂为CuI,Cu₂HgI₄是氧化产物,反应中每生成1 mol Cu₂HgI₄转移2 mol电子。
(1)CuI I₂
(2)2Cu + I₂ = 2CuI
(3)> 高
(4)AC
解析:
(1)氧化性:Cu²⁺>I₂>Cu⁺,还原性:Cu>I⁻>Cu⁺,所以Cu²⁺和I⁻反应,Cu²⁺被还原为Cu⁺,I⁻被氧化为I₂,Cu⁺和I⁻结合生成难溶于水的CuI沉淀,所以反应的产物是CuI、I₂。
(2)久置于空气中的HI溶液呈黄色,是因为其中的碘离子被空气中的O₂氧化为碘单质,加入金属铜,金属铜可以和碘单质反应生成CuI,反应的化学方程式为2Cu + I₂ = 2CuI。
(3)欲消除HI溶液的黄色,也可向其中通入少量H₂S,当浓度接近时,碘单质可以和硫化氢反应生成单质硫和碘化氢,还原性:H₂S>I⁻。
(4)该反应中铜元素化合价由+1降低为0,汞元素化合价由0升高为+2,被氧化的元素是汞元素,氧化剂为CuI,Cu₂HgI₄是氧化产物,反应中每生成1 mol Cu₂HgI₄转移2 mol电子。
18.保护水资源、合理利用废水、节省水资源、加强废水的回收利用已被越来越多的人关注。已知:某无色废水中可能含有$H^{+}$、$NH_{4}^{+}$、$Fe^{3+}$、$Al^{3+}$、$Mg^{2+}$、$Na^{+}$、$NO_{3}^{-}$、$CO_{3}^{2-}$、$SO_{4}^{2-}$中的几种,为分析其成分,分别取废水样品$1L$进行了三组实验,其操作和有关图像如下所示:
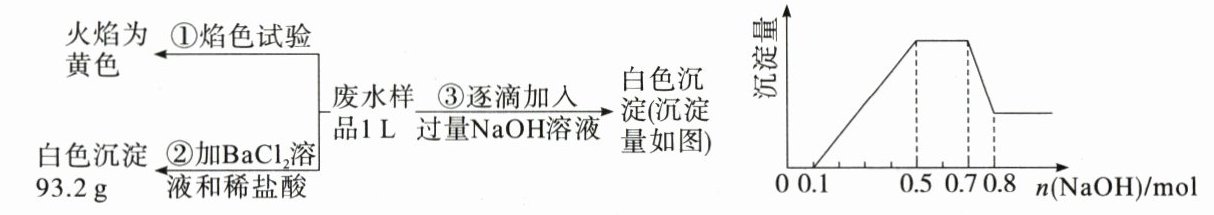
请回答下列问题:
(1)根据上述三组实验可以分析废水中一定不存在的阴离子是________,一定存在的阳离子是______________________________。
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生的离子方程式:______________________________。
(3)分析图像,在原溶液中$c(NH_{4}^{+})$与$c(Al^{3+})$的比值为________,所得沉淀的最大质量是________g。
(4)若通过实验确定原废水中$c(Na^{+})=0.18mol\cdot L^{-1}$,试判断原废水中$NO_{3}^{-}$是否存在?________(填“存在”“不存在”或“不确定")。若存在,$c(NO_{3}^{-})=$________(若不存在或不确定,则此空不填)$mol\cdot L^{-1}$。

请回答下列问题:
(1)根据上述三组实验可以分析废水中一定不存在的阴离子是________,一定存在的阳离子是______________________________。
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生的离子方程式:______________________________。
(3)分析图像,在原溶液中$c(NH_{4}^{+})$与$c(Al^{3+})$的比值为________,所得沉淀的最大质量是________g。
(4)若通过实验确定原废水中$c(Na^{+})=0.18mol\cdot L^{-1}$,试判断原废水中$NO_{3}^{-}$是否存在?________(填“存在”“不存在”或“不确定")。若存在,$c(NO_{3}^{-})=$________(若不存在或不确定,则此空不填)$mol\cdot L^{-1}$。
答案:
(1)CO₃²⁻ Na⁺、H⁺、Al³⁺、Mg²⁺、NH₄⁺
(2)NH₄⁺ + OH⁻ = NH₃·H₂O(或NH₄⁺ + OH⁻ = NH₃↑ + H₂O)
(3)2 : 1 10.7
(4)存在 0.08
解析:无色废水中肯定不存在Fe³⁺,根据实验①确定存在Na⁺,根据实验②确定存在SO₄²⁻,根据实验③结合题图可知,溶液中有H⁺、NH₄⁺、Al³⁺、Mg²⁺,因为CO₃²⁻与H⁺、Al³⁺、Mg²⁺不能共存,所以无CO₃²⁻。n(SO₄²⁻)= 93.2 g / 233 g·mol⁻¹ = 0.4 mol,根据题图求出n(Al³⁺)=n[Al(OH)₃]=0.8 mol - 0.7 mol = 0.1 mol,n(NH₄⁺)=0.7 mol - 0.5 mol = 0.2 mol,n(H⁺)=0.1 mol,生成0.1 mol Al(OH)₃消耗0.3 mol NaOH,则生成Mg(OH)₂消耗的氢氧化钠为0.5 mol - 0.1 mol - 0.3 mol = 0.1 mol,即含有Mg²⁺的物质的量是0.05 mol。
(3)根据上述分析,在原溶液中$\frac{c(NH₄⁺)}{c(Al³⁺)}$ = 0.2 mol / 0.1 mol = 2 / 1,沉淀最多时含有0.1 mol Al(OH)₃和0.05 mol Mg(OH)₂,其质量为0.1 mol×78 g·mol⁻¹ + 0.05 mol×58 g·mol⁻¹ = 10.7 g。
(4)根据上述分析,若通过实验确定原废水中c(Na⁺)=0.18 mol·L⁻¹,即1 L废水中含有0.18 mol Na⁺,根据电荷守恒,则含有0.08 mol NO₃⁻,c(NO₃⁻)= 0.08 mol / 1 L = 0.08 mol·L⁻¹。
(1)CO₃²⁻ Na⁺、H⁺、Al³⁺、Mg²⁺、NH₄⁺
(2)NH₄⁺ + OH⁻ = NH₃·H₂O(或NH₄⁺ + OH⁻ = NH₃↑ + H₂O)
(3)2 : 1 10.7
(4)存在 0.08
解析:无色废水中肯定不存在Fe³⁺,根据实验①确定存在Na⁺,根据实验②确定存在SO₄²⁻,根据实验③结合题图可知,溶液中有H⁺、NH₄⁺、Al³⁺、Mg²⁺,因为CO₃²⁻与H⁺、Al³⁺、Mg²⁺不能共存,所以无CO₃²⁻。n(SO₄²⁻)= 93.2 g / 233 g·mol⁻¹ = 0.4 mol,根据题图求出n(Al³⁺)=n[Al(OH)₃]=0.8 mol - 0.7 mol = 0.1 mol,n(NH₄⁺)=0.7 mol - 0.5 mol = 0.2 mol,n(H⁺)=0.1 mol,生成0.1 mol Al(OH)₃消耗0.3 mol NaOH,则生成Mg(OH)₂消耗的氢氧化钠为0.5 mol - 0.1 mol - 0.3 mol = 0.1 mol,即含有Mg²⁺的物质的量是0.05 mol。
(3)根据上述分析,在原溶液中$\frac{c(NH₄⁺)}{c(Al³⁺)}$ = 0.2 mol / 0.1 mol = 2 / 1,沉淀最多时含有0.1 mol Al(OH)₃和0.05 mol Mg(OH)₂,其质量为0.1 mol×78 g·mol⁻¹ + 0.05 mol×58 g·mol⁻¹ = 10.7 g。
(4)根据上述分析,若通过实验确定原废水中c(Na⁺)=0.18 mol·L⁻¹,即1 L废水中含有0.18 mol Na⁺,根据电荷守恒,则含有0.08 mol NO₃⁻,c(NO₃⁻)= 0.08 mol / 1 L = 0.08 mol·L⁻¹。
查看更多完整答案,请扫码查看


