2025年红对勾高考一轮复习金卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年红对勾高考一轮复习金卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第120页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
- 第213页
- 第214页
- 第215页
- 第216页
- 第217页
- 第218页
- 第219页
- 第220页
- 第221页
- 第222页
- 第223页
- 第224页
- 第225页
- 第226页
- 第227页
- 第228页
- 第229页
- 第230页
- 第231页
- 第232页
- 第233页
- 第234页
- 第235页
- 第236页
- 第237页
- 第238页
- 第239页
- 第240页
- 第241页
- 第242页
- 第243页
- 第244页
- 第245页
14.(2024·北京朝阳区二模)土壤中的微生物可将大气中的H2S经两步反应氧化成SO42-,两步反应的能量变化如图所示。
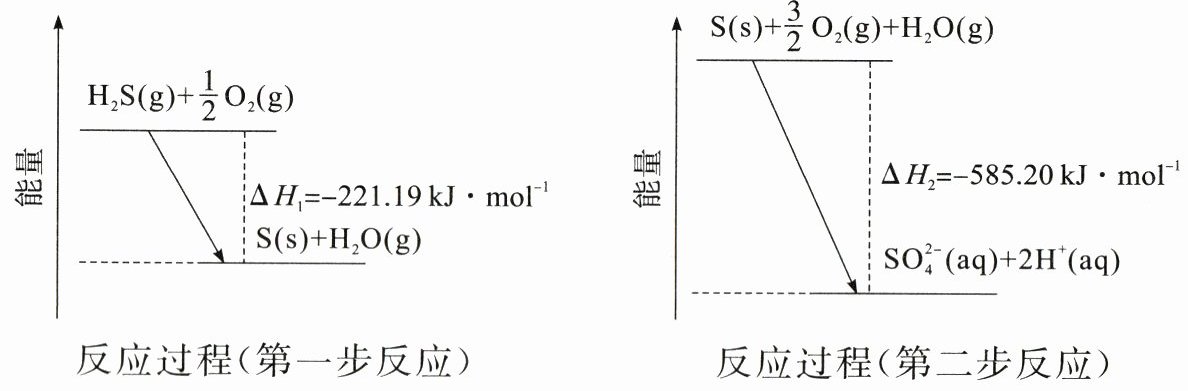
下列说法不正确的是( )
A. O的非金属性大于S,推知热稳定性:H2O>H2S
B. 两步反应中化学键断裂吸收的总能量均小于化学键形成释放的总能量
C. H2S(g)+2O2(g)=2H+(aq)+SO42-(aq) ΔH=-364.01 kJ·mol-1
D. 结合S(s)的燃烧热,可求算2H2S(g)+3O2(g)=2SO2(g)+2H2O(g)的ΔH

下列说法不正确的是( )
A. O的非金属性大于S,推知热稳定性:H2O>H2S
B. 两步反应中化学键断裂吸收的总能量均小于化学键形成释放的总能量
C. H2S(g)+2O2(g)=2H+(aq)+SO42-(aq) ΔH=-364.01 kJ·mol-1
D. 结合S(s)的燃烧热,可求算2H2S(g)+3O2(g)=2SO2(g)+2H2O(g)的ΔH
答案:
C A项,非金属性越强的元素简单气态氢化物稳定性越强,O的非金属性比S强,推知热稳定性H2O>H2S,正确;B项,由题图可知两步反应均为放热反应,所以反应物化学键断裂吸收的能量均小于生成物化学键形成放出的能量,正确;C项,由题图可知,第一步反应的热化学方程式为H2S(g)+$\frac{1}{2}$O2(g)=S(s)+H2O(g) ΔH = -221.19 kJ·mol-1,第二步反应的热化学方程式为S(s)+$\frac{3}{2}$O2(g)+H2O(g)=SO42-(aq)+2H+(aq) ΔH = -585.20 kJ·mol-1,根据盖斯定律,将两式相加H2S(g)+2O2(g)=2H+(aq)+SO42-(aq) ΔH = -806.39 kJ·mol-1,错误;D项,结合S(s)的燃烧热可得到代表S(s)的燃烧热的热化学方程式,再结合第一步热化学方程式,可求算2H2S(g)+3O2(g)=2SO2(g)+2H2O(g)的ΔH,正确。
15. 标准状态下,1 mol纯物质的相对能量及解离为气态原子时所消耗的能量如下表所示:

下列说法正确的是( )
A. x =180
B. 逐级断开CH4(g)中的每摩尔C—H所消耗的能量均为414 kJ
C. 解离每摩尔C(s,石墨)中的碳碳键平均耗能为239 kJ
D. 根据4NO(g)+CH4(g)⇌CO2(g)+2N2(g)+2H2O(g)的ΔH可计算出H—O的键能

下列说法正确的是( )
A. x =180
B. 逐级断开CH4(g)中的每摩尔C—H所消耗的能量均为414 kJ
C. 解离每摩尔C(s,石墨)中的碳碳键平均耗能为239 kJ
D. 根据4NO(g)+CH4(g)⇌CO2(g)+2N2(g)+2H2O(g)的ΔH可计算出H—O的键能
答案:
D A项,焓变 = 生成物总能量 - 反应物总能量,则N2(g)+O2(g)⇌2NO(g) ΔH = 2x kJ·mol-1,焓变 = 反应物总键能 - 生成物总键能,即498 + 946 - 632×2 = 2x,x = 90,故错误;B项,逐级断开CH4(g)中的每摩尔C—H所消耗的能量不相等,故错误;C项,石墨晶体中每个碳原子形成3条共价键,两个碳原子形成1条键,则1mol石墨含有1.5molC—C键,解离每摩尔C(s,石墨)中的碳碳键平均耗能为478kJ,故错误;D项,焓变 = 反应物总键能 - 生成物总键能,C(s,石墨)+O2(g)⇌CO2(g)的ΔH可计算出y值,再根据4NO(g)+CH4(g)⇌CO2(g)+2N2(g)+2H2O(g)的ΔH可计算出H—O的键能,故D正确。
16.(1)已知CH3OH(l)的燃烧热ΔH=-726.5 kJ·mol-1,CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a ______(填“>”“<”或“=”)726.5。
(2)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145.0 kJ热量,写出该反应的热化学方程式:______________________________。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176.0 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为____________。
(4)CO2与H2在某催化剂的作用下反应如图所示:

写出该反应的热化学方程式:______________________________。
(2)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145.0 kJ热量,写出该反应的热化学方程式:______________________________。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176.0 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为____________。
(4)CO2与H2在某催化剂的作用下反应如图所示:

写出该反应的热化学方程式:______________________________。
答案:
(1)<
(2)2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH = -290.0 kJ·mol-1
(3)98.0 kJ
(4)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH = -46 kJ·mol-1
解析:
(1)该反应未完全燃烧,生成的氢气燃烧还要放出热量,则a<726.5。
(2)当有1molCl2参与反应时释放出145.0kJ热量,该反应的热化学方程式:2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH = -145.0kJ·mol-1×2 = -290.0 kJ·mol-1。
(3)4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH = -1176.0 kJ·mol-1,每转移12mol电子放出的热量为1176.0kJ,则反应过程中,每转移1mol电子放出的热量为$\frac{1176.0}{12}$kJ = 98.0kJ。
(4)由反应图示可知图形与化学键对应关系为
|H—H|C—O|C=O|O—H|C—H|
|----|----|----|----|----|
| | | | | |
ΔH = 反应物总键能 - 生成物总键能 = 2×803 kJ·mol-1+3×436 kJ·mol-1-3×414 kJ·mol-1-326 kJ·mol-1-3×464 kJ·mol-1 = -46 kJ·mol-1。
(1)<
(2)2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH = -290.0 kJ·mol-1
(3)98.0 kJ
(4)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH = -46 kJ·mol-1
解析:
(1)该反应未完全燃烧,生成的氢气燃烧还要放出热量,则a<726.5。
(2)当有1molCl2参与反应时释放出145.0kJ热量,该反应的热化学方程式:2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH = -145.0kJ·mol-1×2 = -290.0 kJ·mol-1。
(3)4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH = -1176.0 kJ·mol-1,每转移12mol电子放出的热量为1176.0kJ,则反应过程中,每转移1mol电子放出的热量为$\frac{1176.0}{12}$kJ = 98.0kJ。
(4)由反应图示可知图形与化学键对应关系为
|H—H|C—O|C=O|O—H|C—H|
|----|----|----|----|----|
| | | | | |
ΔH = 反应物总键能 - 生成物总键能 = 2×803 kJ·mol-1+3×436 kJ·mol-1-3×414 kJ·mol-1-326 kJ·mol-1-3×464 kJ·mol-1 = -46 kJ·mol-1。
查看更多完整答案,请扫码查看


