2025年红对勾高考一轮复习金卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年红对勾高考一轮复习金卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第172页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
- 第213页
- 第214页
- 第215页
- 第216页
- 第217页
- 第218页
- 第219页
- 第220页
- 第221页
- 第222页
- 第223页
- 第224页
- 第225页
- 第226页
- 第227页
- 第228页
- 第229页
- 第230页
- 第231页
- 第232页
- 第233页
- 第234页
- 第235页
- 第236页
- 第237页
- 第238页
- 第239页
- 第240页
- 第241页
- 第242页
- 第243页
- 第244页
- 第245页
14.(2024·北京第一〇一中学期末)已知:25 ℃时有关弱酸的电离平衡常数如表所示。下列有关说法正确的是( )
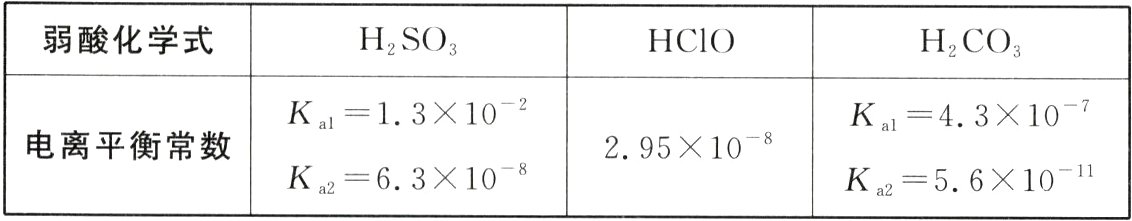
A.等物质的量浓度的酸溶液pH关系:pH(HClO)<pH(H₂CO₃)<pH(H₂SO₃)
B.粒子结合质子能力强弱关系:CO₃²⁻>ClO⁻>HSO₃⁻
C.少量的CO₂通入NaClO溶液中发生反应:2ClO⁻ + CO₂ + H₂O = CO₃²⁻ + 2HClO
D.足量的SO₂通入NaClO溶液中发生反应:ClO⁻ + SO₂ + H₂O = HSO₃⁻ + 2HClO

A.等物质的量浓度的酸溶液pH关系:pH(HClO)<pH(H₂CO₃)<pH(H₂SO₃)
B.粒子结合质子能力强弱关系:CO₃²⁻>ClO⁻>HSO₃⁻
C.少量的CO₂通入NaClO溶液中发生反应:2ClO⁻ + CO₂ + H₂O = CO₃²⁻ + 2HClO
D.足量的SO₂通入NaClO溶液中发生反应:ClO⁻ + SO₂ + H₂O = HSO₃⁻ + 2HClO
答案:
弱酸的电离平衡常数越大,该弱酸的酸性就越强,等浓度的相应弱酸电离产生的c(H⁺)越大。盐水解规律是有弱才水解,谁弱谁水解,谁强显谁性。盐水解程度越大,等浓度的弱酸盐水解使盐溶液显碱性,溶液pH就越大,同时要结合物质的氧化性、还原性分析解答。弱酸的电离平衡常数越大,相应弱酸的酸性就越强,等浓度的弱酸电离产生的c(H⁺)就越大,溶液的pH就越小;根据弱酸电离平衡常数可知酸性:H₂SO₃>H₂CO₃>HSO₃⁻>HClO>HCO₃⁻,则相应溶液的pH大小关系:pH(HClO)>pH(H₂CO₃)>pH(H₂SO₃),A错误;弱酸的酸性越弱,说明其电离产生的弱酸根离子结合H⁺的能力就越强,根据弱酸电离平衡常数可知酸性:H₂SO₃>H₂CO₃>HSO₃⁻>HClO>HCO₃⁻,则结合H⁺的能力:CO₃²⁻>ClO⁻>HSO₃⁻,B正确;根据弱酸电离平衡常数可知酸性:H₂SO₃>H₂CO₃>HSO₃⁻>HClO>HCO₃⁻,将少量的CO₂通入NaClO溶液中发生反应,产生HClO、HCO₃⁻,反应的离子方程式为ClO⁻ + CO₂ + H₂O = HClO + HCO₃⁻,C错误;SO₂具有还原性,NaClO具有强氧化性,二者在溶液中会发生氧化还原反应,产生H₂SO₄、NaCl,该反应的离子方程式为SO₂ + H₂O + ClO⁻ = Cl⁻ + 2H⁺ + SO₄²⁻,D错误。
15.(2024·福建莆田二模)室温下,向水中通入H₂X气体使其保持浓度为a mol·L⁻¹的饱和状态,调节溶液的pH,体系中lg c(M)(M表示HX⁻或X²⁻)与pH的关系如图所示。已知H₂X的lg Ka1 = -7.0、lg Ka2 = -12.9。下列说法错误的是( )
A.a = 0.1
B.曲线②代表lg c(X²⁻)与pH的关系
C.pH = 4.8时,c(H⁺)=c(OH⁻)+c(HX⁻)+2c(X²⁻)
D.若X²⁻浓度处于P点时,需调低溶液的pH才能达到平衡体系

A.a = 0.1
B.曲线②代表lg c(X²⁻)与pH的关系
C.pH = 4.8时,c(H⁺)=c(OH⁻)+c(HX⁻)+2c(X²⁻)
D.若X²⁻浓度处于P点时,需调低溶液的pH才能达到平衡体系

答案:
H₂X为弱酸,存在电离平衡:H₂X⇌H⁺ + HX⁻、HX⁻⇌H⁺ + X²⁻,pH较小、相同pH时,HX⁻浓度大于X²⁻,lg c(HX⁻)>lg c(X²⁻),则图中曲线①代表lg c(HX⁻)与pH的关系,曲线②代表lg c(X²⁻)与pH的关系;已知H₂X的lg Ka₁ = -7.0、lg Ka₂ = -12.9,则Ka₁ = 10⁻⁷.⁰、Ka₂ = 10⁻¹².⁹。据分析,由点(3, - 5),结合Ka₁ = $\frac{c(HX^{-})\cdot c(H^{+})}{c(H_{2}X)}=\frac{10^{-5}\times10^{-3}}{c(H_{2}X)}=10^{-7.0}$,得到c(H₂X)=a mol·L⁻¹ = 0.1 mol·L⁻¹,A正确;据分析,曲线②代表lg c(X²⁻)与pH的关系,B正确;室温下,向水中通入H₂X气体使其保持浓度为a mol·L⁻¹的饱和状态,所得溶液pH是一确定的值,若调节溶液的pH的过程中引入其他阳离子达到pH = 4.8时,则选项式子不符合电荷守恒,C不正确;由图可知,P点c(X²⁻)在平衡点下方,P点向左平移会在曲线②上,故需调低pH才能达到平衡体系,D正确。
16.(2024·山东日照高三模拟)硫及其化合物在日常生活、工业生产中都非常普遍。
(1)在水中,H₂SO₄是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为H₂SO₄ = H⁺ + HSO₄⁻、HSO₄⁻⇌H⁺ + SO₄²⁻。
①25 ℃时,Na₂SO₄溶液的pH ______(填“>”“<”或“=”)7。
②0.100 mol·L⁻¹的稀硫酸中,c(H⁺)=0.109 mol·L⁻¹,求H₂SO₄第二步电离的电离常数:______________________________(写出计算过程,结果保留三位有效数字)。
(2)液态水中,水存在自偶电离:H₂O + H₂O⇌H₃O⁺ + OH⁻。平常书写的H⁺,实际上是纯水或水溶液中H₃O⁺的缩写。如HCl在水中电离,完整写法是HCl + H₂O = H₃O⁺ + Cl⁻。
①常温下冰醋酸(用HAc表示)中,同样存在HAc的自偶电离,其电离方程式可表示为____________________。
②用冰醋酸作溶剂时,H₂SO₄是一种二元弱酸。将少量H₂SO₄溶于冰醋酸中,第一步电离的完整写法是____________________。若保持温度不变,关于该所得溶液,下列说法正确的是 ______(填字母)。
A.加入少量冰醋酸,c(HSO₄⁻)与c(SO₄²⁻)均减小
B.加入少量H₂SO₄,H₂SO₄的电离程度增大
C.加入少量NaAc固体,c(HSO₄⁻)与c(SO₄²⁻)的比值减小
D.加入少量Na₂SO₄固体,c(Ac⁻)减小
(1)在水中,H₂SO₄是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为H₂SO₄ = H⁺ + HSO₄⁻、HSO₄⁻⇌H⁺ + SO₄²⁻。
①25 ℃时,Na₂SO₄溶液的pH ______(填“>”“<”或“=”)7。
②0.100 mol·L⁻¹的稀硫酸中,c(H⁺)=0.109 mol·L⁻¹,求H₂SO₄第二步电离的电离常数:______________________________(写出计算过程,结果保留三位有效数字)。
(2)液态水中,水存在自偶电离:H₂O + H₂O⇌H₃O⁺ + OH⁻。平常书写的H⁺,实际上是纯水或水溶液中H₃O⁺的缩写。如HCl在水中电离,完整写法是HCl + H₂O = H₃O⁺ + Cl⁻。
①常温下冰醋酸(用HAc表示)中,同样存在HAc的自偶电离,其电离方程式可表示为____________________。
②用冰醋酸作溶剂时,H₂SO₄是一种二元弱酸。将少量H₂SO₄溶于冰醋酸中,第一步电离的完整写法是____________________。若保持温度不变,关于该所得溶液,下列说法正确的是 ______(填字母)。
A.加入少量冰醋酸,c(HSO₄⁻)与c(SO₄²⁻)均减小
B.加入少量H₂SO₄,H₂SO₄的电离程度增大
C.加入少量NaAc固体,c(HSO₄⁻)与c(SO₄²⁻)的比值减小
D.加入少量Na₂SO₄固体,c(Ac⁻)减小
答案:
(1)①> ②第一步完全电离,电离出0.100 mol·L⁻¹的H⁺,故第二步电离出0.009 mol·L⁻¹的H⁺和SO₄²⁻,c(HSO₄⁻)=(0.100 - 0.009) mol·L⁻¹ = 0.091 mol·L⁻¹,Ka = $\frac{c(H^{+})\cdot c(SO_{4}^{2-})}{c(HSO_{4}^{-})}=\frac{0.109\times0.009}{0.091}\approx1.08\times10^{-2}$
(2)①HAc + HAc⇌H₂Ac⁺ + Ac⁻ ②H₂SO₄ + HAc⇌H₂Ac⁺ + HSO₄⁻
解析:
(1)在水中,H₂SO₄是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为H₂SO₄ = H⁺ + HSO₄⁻、HSO₄⁻⇌H⁺ + SO₄²⁻。①根据HSO₄⁻⇌H⁺ + SO₄²⁻,25℃时,Na₂SO₄溶液中硫酸根离子水解生成硫酸氢根离子和氢氧根离子,导致溶液中氢氧根离子浓度大于氢离子浓度,因此溶液的pH>7。②0.100 mol·L⁻¹的稀硫酸中,c(H⁺)=0.109 mol·L⁻¹,H₂SO₄第一步完全电离,可电离出0.100 mol·L⁻¹的H⁺,故第二步电离出0.009 mol·L⁻¹的H⁺和SO₄²⁻,c(HSO₄⁻)=(0.100 - 0.009) mol·L⁻¹ = 0.091 mol·L⁻¹,Ka = $\frac{c(H^{+})\cdot c(SO_{4}^{2-})}{c(HSO_{4}^{-})}=\frac{0.109\times0.009}{0.091}\approx1.08\times10^{-2}$。
(2)①根据H₂O + H₂O⇌H₃O⁺ + OH⁻分析,其电离方程式可表示为HAc + HAc⇌H₂Ac⁺ + Ac⁻。②用冰醋酸作溶剂时,H₂SO₄是一种二元弱酸。将少量H₂SO₄溶于冰醋酸,H₂SO₄电离出的氢离子与HAc结合成H₂Ac⁺,因此第一步电离的完整写法是H₂SO₄ + HAc⇌H₂Ac⁺ + HSO₄⁻。若保持温度不变:加入少量冰醋酸,由于溶液体积增大为主要因素,因此c(HSO₄⁻)与c(SO₄²⁻)均减小,A正确;加入少量H₂SO₄,平衡正向移动,由于H₂SO₄浓度增大为主要因素,因此H₂SO₄的电离程度减小,B错误;加入少量NaAc固体,Ac⁻与氢离子结合,硫酸氢根离子电离程度增大,硫酸氢根离子浓度减小,硫酸根离子浓度增大,则c(HSO₄⁻)与c(SO₄²⁻)的比值减小,C正确;加入少量Na₂SO₄固体,抑制硫酸氢根离子电离,增大了HAc的自偶电离,则c(Ac⁻)增大,D错误。
(1)①> ②第一步完全电离,电离出0.100 mol·L⁻¹的H⁺,故第二步电离出0.009 mol·L⁻¹的H⁺和SO₄²⁻,c(HSO₄⁻)=(0.100 - 0.009) mol·L⁻¹ = 0.091 mol·L⁻¹,Ka = $\frac{c(H^{+})\cdot c(SO_{4}^{2-})}{c(HSO_{4}^{-})}=\frac{0.109\times0.009}{0.091}\approx1.08\times10^{-2}$
(2)①HAc + HAc⇌H₂Ac⁺ + Ac⁻ ②H₂SO₄ + HAc⇌H₂Ac⁺ + HSO₄⁻
解析:
(1)在水中,H₂SO₄是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为H₂SO₄ = H⁺ + HSO₄⁻、HSO₄⁻⇌H⁺ + SO₄²⁻。①根据HSO₄⁻⇌H⁺ + SO₄²⁻,25℃时,Na₂SO₄溶液中硫酸根离子水解生成硫酸氢根离子和氢氧根离子,导致溶液中氢氧根离子浓度大于氢离子浓度,因此溶液的pH>7。②0.100 mol·L⁻¹的稀硫酸中,c(H⁺)=0.109 mol·L⁻¹,H₂SO₄第一步完全电离,可电离出0.100 mol·L⁻¹的H⁺,故第二步电离出0.009 mol·L⁻¹的H⁺和SO₄²⁻,c(HSO₄⁻)=(0.100 - 0.009) mol·L⁻¹ = 0.091 mol·L⁻¹,Ka = $\frac{c(H^{+})\cdot c(SO_{4}^{2-})}{c(HSO_{4}^{-})}=\frac{0.109\times0.009}{0.091}\approx1.08\times10^{-2}$。
(2)①根据H₂O + H₂O⇌H₃O⁺ + OH⁻分析,其电离方程式可表示为HAc + HAc⇌H₂Ac⁺ + Ac⁻。②用冰醋酸作溶剂时,H₂SO₄是一种二元弱酸。将少量H₂SO₄溶于冰醋酸,H₂SO₄电离出的氢离子与HAc结合成H₂Ac⁺,因此第一步电离的完整写法是H₂SO₄ + HAc⇌H₂Ac⁺ + HSO₄⁻。若保持温度不变:加入少量冰醋酸,由于溶液体积增大为主要因素,因此c(HSO₄⁻)与c(SO₄²⁻)均减小,A正确;加入少量H₂SO₄,平衡正向移动,由于H₂SO₄浓度增大为主要因素,因此H₂SO₄的电离程度减小,B错误;加入少量NaAc固体,Ac⁻与氢离子结合,硫酸氢根离子电离程度增大,硫酸氢根离子浓度减小,硫酸根离子浓度增大,则c(HSO₄⁻)与c(SO₄²⁻)的比值减小,C正确;加入少量Na₂SO₄固体,抑制硫酸氢根离子电离,增大了HAc的自偶电离,则c(Ac⁻)增大,D错误。
查看更多完整答案,请扫码查看


