2025年红对勾高考一轮复习金卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年红对勾高考一轮复习金卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第132页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
- 第213页
- 第214页
- 第215页
- 第216页
- 第217页
- 第218页
- 第219页
- 第220页
- 第221页
- 第222页
- 第223页
- 第224页
- 第225页
- 第226页
- 第227页
- 第228页
- 第229页
- 第230页
- 第231页
- 第232页
- 第233页
- 第234页
- 第235页
- 第236页
- 第237页
- 第238页
- 第239页
- 第240页
- 第241页
- 第242页
- 第243页
- 第244页
- 第245页
12.(2024·山东省实验中学二模)钙(锂)介导电化学合成氨低能耗,效率高,是合成氨研究的热点领域,以下为该装置示意图,下列有关说法正确的是 ( )
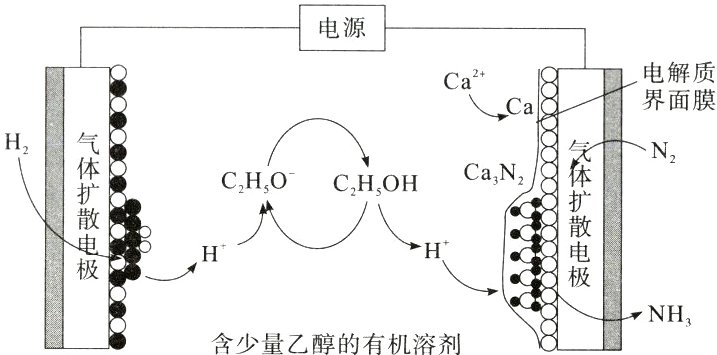
A.阴极区反应:H₂ + 2C₂H₅O⁻ + 2e⁻ = 2C₂H₅OH
B.此装置降低合成氨能耗的主要原因是钙或锂等金属能高效解离氮气形成相应的氮化物
C.含少量乙醇的水溶液会使该装置生产效率提高
D.整个装置每生成1mol氨消耗1.5molCa²⁺

A.阴极区反应:H₂ + 2C₂H₅O⁻ + 2e⁻ = 2C₂H₅OH
B.此装置降低合成氨能耗的主要原因是钙或锂等金属能高效解离氮气形成相应的氮化物
C.含少量乙醇的水溶液会使该装置生产效率提高
D.整个装置每生成1mol氨消耗1.5molCa²⁺
答案:
B由图可知,通入氢气的电极为阳极,氢气在阳极失去电子发生氧化反应生成氢离子,氢离子与C₂H₅O⁻反应生成C₂H₅OH,C₂H₅OH解离出氢离子和C₂H₅O⁻,通入氮气的电极为阴极,钙离子在阴极得到电子生成钙,钙与氮气反应生成Ca₃N₂,Ca₃N₂与氢离子反应生成Ca²⁺和氨气,则阴极的电极反应式为Ca²⁺ + 2e⁻ = Ca,N₂ + 3Ca = Ca₃N₂,Ca₃N₂ + 6H⁺ = 3Ca²⁺ + 2NH₃,电解的总反应为N₂ + 3H₂ 电解 2NH₃,据此分析解题。由分析可知,H₂在阳极上失去电子,故阳极区反应式为H₂ + 2C₂H₅O⁻ - 2e⁻ = 2C₂H₅OH,A错误;此装置降低合成氨能耗的主要原因是钙或锂等金属能高效解离氮气形成相应的氮化物,B正确;由于水能与Ca直接反应,故含少量乙醇的水溶液不会使该装置生产效率提高反而降低,C错误;电解的总反应为N₂ + 3H₂ 电解 2NH₃,故整个装置每生成1mol氨,不消耗Ca²⁺,Ca²⁺只是电解质导电,D错误。
13.(2024·广西贵港模拟)乙醛酸(OHC—COOH)是一种重要的化工中间体。工业上以乙二醛为原料制备乙醛酸的装置如图所示,通电后,阳极产物将乙二醛氧化化为乙醛酸。下列说法错误的是 ( )
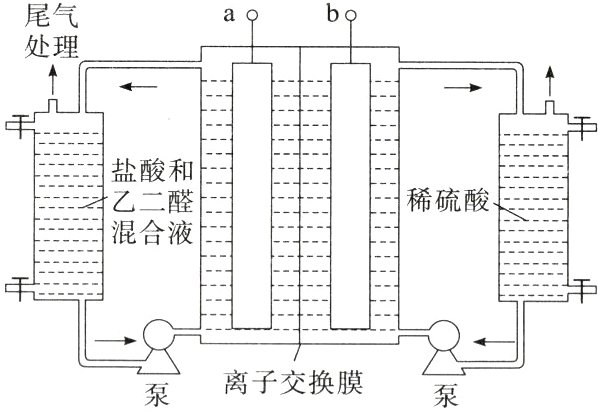
A.a极电势高于b极
B.离子交换膜为阴离子交换膜
C.当有0.5mol离子通过离子交换膜时,理论上最多可生成乙醛酸的质量为18.5g
D.乙二醛被氧化的化学方程式:
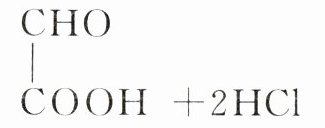

A.a极电势高于b极
B.离子交换膜为阴离子交换膜
C.当有0.5mol离子通过离子交换膜时,理论上最多可生成乙醛酸的质量为18.5g
D.乙二醛被氧化的化学方程式:

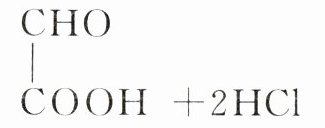
答案:
B由题中信息:通电后,阳极产物将乙二醛氧化为乙醛酸,结合题中装置图可知,阳极生成的Cl₂通入盛放盐酸和乙二醛混合液一侧,Cl₂可将乙二醛发生氧化还原反应,生成的Cl⁻移向与a电极相连的电极,与b电极相连的电极发生还原反应,生成H₂,a为电源正极,b为电源负极。根据电解原理,可知阳极的电极反应式为2Cl⁻ - 2e⁻ = Cl₂↑,阴极发生还原反应,电极反应式为2H⁺ + 2e⁻ = H₂↑。据分析,a电极为正极,b电极为负极,因此a极电势高于b极,故A正确;根据题意氢离子由左侧经离子交换膜进入右侧,则离子交换膜为阳离子交换膜,故B错误;根据得失电子守恒,有1mol OHC - COOH~1mol Cl₂~2mol e⁻,则当有0.5mol离子通过离子交换膜时,理论上最多可生成乙醛酸的质量为1×$\frac{0.5}{2}$ mol×74g·mol⁻¹ = 18.5g,故C正确;氯气将乙二醛氧化为乙醛酸,自身被还原为氯离子,化学方程式为 + H₂O + Cl₂ → + 2HCl,故D正确。
14.(2024·重庆渝西中学模拟)利用双极膜电渗析法(BMED)进行碳吸收,采用双极膜、阳离子交换膜、阴离子交换膜,通过隔板分离成盐室(NaCl溶液)、碱室(0.1mol·L⁻¹NaHCO₃溶液)、酸室(0.1mol·L⁻¹HCl溶液)、极室(0.25mol·L⁻¹Na₂SO₄溶液),实验装置如图所示。接通电源,调至实验设置电流,开始循环并向碱室通入CO₂制备Na₂CO₃和NaHCO₃溶液,忽略各室溶液的体积变化。下列说法错误的是 ( )

A.M连接电源负极,相同条件下,电极M、N产生气体的体积比为2∶1
B.a膜、b膜、c膜分别为阳离子交换膜、双极膜、阴离子交换膜
C.极室、盐室的pH保持不变,酸室pH减小,碱室的pH可能增大
D.当酸室产生0.4molHCl时,双极膜电离出OH⁻的数目为4.816×10²³

A.M连接电源负极,相同条件下,电极M、N产生气体的体积比为2∶1
B.a膜、b膜、c膜分别为阳离子交换膜、双极膜、阴离子交换膜
C.极室、盐室的pH保持不变,酸室pH减小,碱室的pH可能增大
D.当酸室产生0.4molHCl时,双极膜电离出OH⁻的数目为4.816×10²³
答案:
B根据装置图可知,b膜中产生的H⁺向M电极移动,则M为阴极,连接电源的负极,N为阳极,连接电源的正极,分析每个室中存在的离子可知,M - b膜之间为极室(Na₂SO₄溶液),b膜 - c膜之间为碱室(NaHCO₃溶液),c膜 - a膜之间为盐室(NaCl溶液),a膜 - b膜之间为酸室(HCl溶液),b膜 - N之间为极室(Na₂SO₄溶液)。A项,M为阴极,连接电源的负极,电极反应式为2H₂O + 2e⁻ = H₂↑ + 2OH⁻,N为阳极,电极反应式为2H₂O - 4e⁻ = O₂↑ + 4H⁺,相同条件下,根据转移的电子数可知,2H₂~4e⁻~O₂,电极M、N产生气体的体积比为2 : 1,正确;B项,题干中说明向碱室通入CO₂制备Na₂CO₃和NaHCO₃溶液,因此b膜要产生OH⁻与CO₂反应,又可知盐室(NaCl溶液)中的钠离子通过c膜移动到碱室,根据电荷守恒,盐室(NaCl溶液)中的氯离子通过a膜移动到酸室,因此a膜、b膜、c膜分别为阴离子交换膜、双极膜、阳离子交换膜,错误;C项,极室中的溶质为硫酸钠,电解硫酸钠实质是电解水,因此极室中pH保持不变,同样氯化钠水溶液为中性,离子的移动不影响pH,因此盐室的pH保持不变,氯离子通过a膜移动到酸室,H⁺通过b膜移动到酸室,HCl浓度增大,因此pH减小,同样碱室中Na₂CO₃和NaHCO₃浓度增大,则碱性增强,因此pH可能增大,正确;D项,当酸室产生0.4mol HCl时,根据电荷守恒可知,b膜产生的0.4mol OH⁻,有2个b膜均产生OH⁻,左侧的b膜产生的OH⁻进入碱室,右侧的b膜产生的OH⁻进入盐室,因此双极膜电离出0.8mol OH⁻,数目为4.816×10²³,正确。
查看更多完整答案,请扫码查看


