2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第94页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
1.(2025·1月浙江卷,12分)二甲胺${[(CH_{3})_{2}NH]}$、$N,N-$二甲基甲酰胺${[HCON(CH_{3})_{2}]}$均是用途广泛的化工原料。
请回答:
(1)用氨和甲醇在密闭容器中合成二甲胺,反应方程式如下:
Ⅰ ${NH_{3}(g) + CH_{3}OH(g)⇌ CH_{3}NH_{2}(g) + H_{2}O(g)}$
Ⅱ ${CH_{3}NH_{2}(g) + CH_{3}OH(g)⇌ (CH_{3})_{2}NH(g) + H_{2}O(g)}$
Ⅲ ${(CH_{3})_{2}NH(g) + CH_{3}OH(g)⇌ (CH_{3})_{3}N(g) + H_{2}O(g)}$
可改变甲醇平衡转化率的因素是
A.温度
B.投料比${[n(NH_{3}):n(CH_{3}OH)]}$
C.压强
D.催化剂
(2)$25\ ^{\circ}C$下,${(CH_{3})_{2}NH· H_{2}O}$的电离常数为$K_{b}$,$-\lg K_{b}=3.2$,则$1\ mol/L\ {[(CH_{3})_{2}NH_{2}]^{+}Cl^{-}}$水溶液的${pH}=$
(3)在${[(CH_{3})_{2}NH_{2}]^{+}Cl^{-}}$的有机溶液中电化学还原${CO_{2}}$制备${HCON(CH_{3})_{2}}$,阴极上生成${HCON(CH_{3})_{2}}$的电极反应方程式是
(4)上述电化学方法产率不高,工业中常用如下反应生产${HCON(CH_{3})_{2}}$:
${(CH_{3})_{2}NH(g) + CO(g)\xlongequal{}HCON(CH_{3})_{2}(l)}$
某条件下反应自发且熵减,则反应在该条件下$\Delta H$
(5)有研究采用${CO_{2}}$、${H_{2}}$和${(CH_{3})_{2}NH}$催化反应制备${HCON(CH_{3})_{2}}$。在恒温密闭容器中,投料比$n{(CO_{2})}:n{(H_{2})}:n{[(CH_{3})_{2}NH]}=20:15:1$,催化剂$M$足量。
反应方程式如下:
Ⅳ ${CO_{2}(g) + H_{2}(g)\xlongequal[碱性物质]{催化剂M} HCOOH(g)}$
Ⅴ ${HCOOH(g) + (CH_{3})_{2}NH(g)\xlongequal{}HCON(CH_{3})_{2}(g) + H_{2}O(g)}$
${HCOOH}$、${(CH_{3})_{2}NH}$、${HCON(CH_{3})_{2}}$三种物质的物质的量百分比随反应时间变化如图所示。
$\begin{cases}例:{HCOOH}的物质的量百分比=\\\dfrac{n{(HCOOH)}}{n{(HCOOH)} + n{[(CH_{3})_{2}NH]} + n{[HCON(CH_{3})_{2}]}}×100\%\end{cases}$

①请解释${HCOOH}$的物质的量百分比随反应时间变化的原因(不考虑催化剂$M$活性降低或失活)
②若用${SiH_{4}}$代替${H_{2}}$作为氢源与${CO_{2}}$反应生成${HCOOH}$,可以降低反应所需温度。请从化学键角度解释原因
请回答:
(1)用氨和甲醇在密闭容器中合成二甲胺,反应方程式如下:
Ⅰ ${NH_{3}(g) + CH_{3}OH(g)⇌ CH_{3}NH_{2}(g) + H_{2}O(g)}$
Ⅱ ${CH_{3}NH_{2}(g) + CH_{3}OH(g)⇌ (CH_{3})_{2}NH(g) + H_{2}O(g)}$
Ⅲ ${(CH_{3})_{2}NH(g) + CH_{3}OH(g)⇌ (CH_{3})_{3}N(g) + H_{2}O(g)}$
可改变甲醇平衡转化率的因素是
AB
。A.温度
B.投料比${[n(NH_{3}):n(CH_{3}OH)]}$
C.压强
D.催化剂
(2)$25\ ^{\circ}C$下,${(CH_{3})_{2}NH· H_{2}O}$的电离常数为$K_{b}$,$-\lg K_{b}=3.2$,则$1\ mol/L\ {[(CH_{3})_{2}NH_{2}]^{+}Cl^{-}}$水溶液的${pH}=$
5.4
。(3)在${[(CH_{3})_{2}NH_{2}]^{+}Cl^{-}}$的有机溶液中电化学还原${CO_{2}}$制备${HCON(CH_{3})_{2}}$,阴极上生成${HCON(CH_{3})_{2}}$的电极反应方程式是
CO_2 + 2e^- + 2[(CH_3)_2NH_2]^+ \xlongequal{} HCON(CH_3)_2 + (CH_3)_2NH + H_2O
。(4)上述电化学方法产率不高,工业中常用如下反应生产${HCON(CH_{3})_{2}}$:
${(CH_{3})_{2}NH(g) + CO(g)\xlongequal{}HCON(CH_{3})_{2}(l)}$
某条件下反应自发且熵减,则反应在该条件下$\Delta H$
<
(填“$>$”“$<$”或“$=$”)0。(5)有研究采用${CO_{2}}$、${H_{2}}$和${(CH_{3})_{2}NH}$催化反应制备${HCON(CH_{3})_{2}}$。在恒温密闭容器中,投料比$n{(CO_{2})}:n{(H_{2})}:n{[(CH_{3})_{2}NH]}=20:15:1$,催化剂$M$足量。
反应方程式如下:
Ⅳ ${CO_{2}(g) + H_{2}(g)\xlongequal[碱性物质]{催化剂M} HCOOH(g)}$
Ⅴ ${HCOOH(g) + (CH_{3})_{2}NH(g)\xlongequal{}HCON(CH_{3})_{2}(g) + H_{2}O(g)}$
${HCOOH}$、${(CH_{3})_{2}NH}$、${HCON(CH_{3})_{2}}$三种物质的物质的量百分比随反应时间变化如图所示。
$\begin{cases}例:{HCOOH}的物质的量百分比=\\\dfrac{n{(HCOOH)}}{n{(HCOOH)} + n{[(CH_{3})_{2}NH]} + n{[HCON(CH_{3})_{2}]}}×100\%\end{cases}$

①请解释${HCOOH}$的物质的量百分比随反应时间变化的原因(不考虑催化剂$M$活性降低或失活)
t 时刻之前反应Ⅳ的速率比反应Ⅴ的快,t 时刻之后由于浓度的影响导致反应Ⅳ的速率比反应Ⅴ的慢
。②若用${SiH_{4}}$代替${H_{2}}$作为氢源与${CO_{2}}$反应生成${HCOOH}$,可以降低反应所需温度。请从化学键角度解释原因
用H_2 作氢源需要断裂H—H键,用SiH_4 作氢源需断裂Si—H键,由于Si原子半径大于H,Si—H的键能比H—H小,所以用SiH_4 代替H_2 作为氢源与CO_2 反应生成HCOOH,可以降低反应所需温度
。
答案:
(1)AB
(2)5.4
$(3)CO_2 + 2e^- + 2[(CH_3)_2NH_2]^+ \xlongequal{} HCON(CH_3)_2 + (CH_3)_2NH + H_2O $
(4)<
(5)①t 时刻之前反应Ⅳ的速率比反应Ⅴ的快,t 时刻之后由于浓度的影响导致反应Ⅳ的速率比反应Ⅴ的慢 ②用$H_2 $作氢源需要断裂H—H键,用$SiH_4 $作氢源需断裂Si—H键,由于Si原子半径大于H,Si—H的键能比H—H小,所以用$SiH_4 $代替$H_2 $作为氢源与$CO_2 $反应生成HCOOH,可以降低反应所需温度
【解析】化学反应原理综合应用
(1)温度改变导致平衡常数改变,所以温度改变一定能改变甲醇平衡转化率,A正确;增大投料比会导致$CH_3OH $平衡转化率增大,减小投料比会导致$CH_3OH $平衡转化率减小,B正确;由题给方程式可知,各反应气体的计量数不变,故改变压强不能改变$CH_3OH $平衡转化率,C错误;催化剂不能使平衡发生移动,D错误。
$(2)[(CH_3)_2NH_2]^+ $水解平衡常数$K_{h} = \frac{K_{w}}{K_{b}} = 10^{-10.8},$因为水解微弱,$c(H^+) \approx \sqrt{K_{h} × c([(CH_3)_2NH_2]^+)} = 10^{-5.4} mol/L,$故pH = 5.4。
(3)电解池阴极发生还原反应,由题意可知,$CO_2 $在阴极上转化为$HCON(CH_3)_2,$故阴极反应式为$CO_2 + 2e^- + 2[(CH_3)_2NH_2]^+ \xlongequal{} HCON(CH_3)_2 + (CH_3)_2NH + H_2O。$
(4)由题意“熵减”可知反应的$\Delta S < 0,$且反应能自发进行,故$\Delta H < 0。$
(5)①观察题图可知,t 时刻前,HCOOH物质的量百分比增大的比$HCON(CH_3)_2 $快,而 t 时刻后HCOOH物质的量百分比逐渐减小至不变,$HCON(CH_3)_2 $物质的量百分比继
(1)AB
(2)5.4
$(3)CO_2 + 2e^- + 2[(CH_3)_2NH_2]^+ \xlongequal{} HCON(CH_3)_2 + (CH_3)_2NH + H_2O $
(4)<
(5)①t 时刻之前反应Ⅳ的速率比反应Ⅴ的快,t 时刻之后由于浓度的影响导致反应Ⅳ的速率比反应Ⅴ的慢 ②用$H_2 $作氢源需要断裂H—H键,用$SiH_4 $作氢源需断裂Si—H键,由于Si原子半径大于H,Si—H的键能比H—H小,所以用$SiH_4 $代替$H_2 $作为氢源与$CO_2 $反应生成HCOOH,可以降低反应所需温度
【解析】化学反应原理综合应用
(1)温度改变导致平衡常数改变,所以温度改变一定能改变甲醇平衡转化率,A正确;增大投料比会导致$CH_3OH $平衡转化率增大,减小投料比会导致$CH_3OH $平衡转化率减小,B正确;由题给方程式可知,各反应气体的计量数不变,故改变压强不能改变$CH_3OH $平衡转化率,C错误;催化剂不能使平衡发生移动,D错误。
$(2)[(CH_3)_2NH_2]^+ $水解平衡常数$K_{h} = \frac{K_{w}}{K_{b}} = 10^{-10.8},$因为水解微弱,$c(H^+) \approx \sqrt{K_{h} × c([(CH_3)_2NH_2]^+)} = 10^{-5.4} mol/L,$故pH = 5.4。
(3)电解池阴极发生还原反应,由题意可知,$CO_2 $在阴极上转化为$HCON(CH_3)_2,$故阴极反应式为$CO_2 + 2e^- + 2[(CH_3)_2NH_2]^+ \xlongequal{} HCON(CH_3)_2 + (CH_3)_2NH + H_2O。$
(4)由题意“熵减”可知反应的$\Delta S < 0,$且反应能自发进行,故$\Delta H < 0。$
(5)①观察题图可知,t 时刻前,HCOOH物质的量百分比增大的比$HCON(CH_3)_2 $快,而 t 时刻后HCOOH物质的量百分比逐渐减小至不变,$HCON(CH_3)_2 $物质的量百分比继
2.【生产环保】(2024·6月浙江卷,10分)氢是清洁能源,硼氢化钠${(NaBH_{4})}$是一种环境友好的固体储氢材料,其水解生氢反应方程式如下(除非特别说明,本题中反应条件均为$25\ ^{\circ}C$、$101\ kPa$): ${NaBH_{4}(s) + 2H_{2}O(l)\xlongequal{}NaBO_{2}(aq) + 4H_{2}(g)}$ $\Delta H<0$
请回答:
(1)该反应能自发进行的条件是
A.高温
B.低温
C.任意温度
D.无法判断
(2)该反应比较缓慢。忽略体积变化的影响,下列措施中可加快反应速率的是
A.升高溶液温度
B.加入少量异丙胺${[(CH_{3})_{2}CHNH_{2}]}$
C.加入少量固体硼酸${[B(OH)_{3}]}$
D.增大体系压强
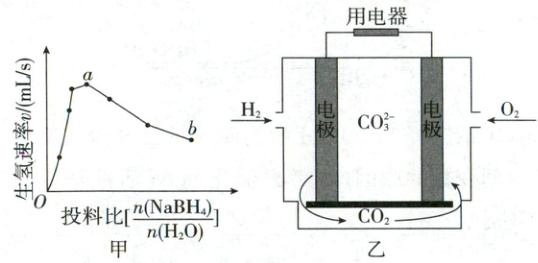
(3)为加速${NaBH_{4}}$水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率$v$与投料比${\left \lbrack\dfrac{n{(NaBH_{4})}}{n{(H_{2}O)}}\right \rbrack}$之间的关系,结果如图甲所示。请解释$ab$段变化的原因
(4)氢能的高效利用途径之一是在燃料电池中产生电能。某研究小组的自制熔融碳酸盐燃料电池工作原理如图乙所示,正极上的电极反应式是
(5)资源的再利用和再循环有利于人类的可持续发展。选用如下方程式,可以设计能自发进行的多种制备方法,将反应副产物偏硼酸钠${(NaBO_{2})}$再生为${NaBH_{4}}$。
(已知:$\Delta G$是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比$\Delta H$计算方法;当$\Delta G<0$时,反应能自发进行)
Ⅰ.${NaBH_{4}(s) + 2H_{2}O(l)\xlongequal{}NaBO_{2}(s) + 4H_{2}(g)}$ $\Delta G_{1}=-320\ kJ/mol$
Ⅱ.${H_{2}(g) + \dfrac{1}{2}O_{2}(g)\xlongequal{}H_{2}O(l)}$ $\Delta G_{2}=-240\ kJ/mol$
Ⅲ.${Mg(s) + \dfrac{1}{2}O_{2}(g)\xlongequal{}MgO(s)}$ $\Delta G_{3}=-570\ kJ/mol$
请书写一个方程式表示${NaBO_{2}}$再生为${NaBH_{4}}$的一种制备方法,并注明$\Delta G$
(要求:反应物不超过三种物质;氢原子利用率为$100\%$)
请回答:
(1)该反应能自发进行的条件是
C
。A.高温
B.低温
C.任意温度
D.无法判断
(2)该反应比较缓慢。忽略体积变化的影响,下列措施中可加快反应速率的是
AC
。A.升高溶液温度
B.加入少量异丙胺${[(CH_{3})_{2}CHNH_{2}]}$
C.加入少量固体硼酸${[B(OH)_{3}]}$
D.增大体系压强
(3)为加速${NaBH_{4}}$水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率$v$与投料比${\left \lbrack\dfrac{n{(NaBH_{4})}}{n{(H_{2}O)}}\right \rbrack}$之间的关系,结果如图甲所示。请解释$ab$段变化的原因
随着投料比\frac{n(NaBH_4)}{n(H_2O)} 的增大,c(NaBH_4)增大,c(H_2O)减小,ab 段生氢速率减小是由于c(H_2O)减小对速率的影响占主导
。(4)氢能的高效利用途径之一是在燃料电池中产生电能。某研究小组的自制熔融碳酸盐燃料电池工作原理如图乙所示,正极上的电极反应式是
O_2 + 2CO_2 + 4e^- \xlongequal{} 2CO_3^{2-}
。该电池以$3.2\ A$恒定电流工作$14$分钟,消耗${H_{2}}$体积为$0.49\ L$,故可测得该电池将化学能转化为电能的转化率为70\%
。[已知:该条件下${H_{2}}$的摩尔体积为$24.5\ L/mol$;电荷量$q{(C)}=$电流$I{(A)}×$时间$t{(s)}$;$N_{A}=6.0× 10^{23}\ mol^{-1}$;$e=1.60× 10^{-19}\ C$](5)资源的再利用和再循环有利于人类的可持续发展。选用如下方程式,可以设计能自发进行的多种制备方法,将反应副产物偏硼酸钠${(NaBO_{2})}$再生为${NaBH_{4}}$。
(已知:$\Delta G$是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比$\Delta H$计算方法;当$\Delta G<0$时,反应能自发进行)
Ⅰ.${NaBH_{4}(s) + 2H_{2}O(l)\xlongequal{}NaBO_{2}(s) + 4H_{2}(g)}$ $\Delta G_{1}=-320\ kJ/mol$
Ⅱ.${H_{2}(g) + \dfrac{1}{2}O_{2}(g)\xlongequal{}H_{2}O(l)}$ $\Delta G_{2}=-240\ kJ/mol$
Ⅲ.${Mg(s) + \dfrac{1}{2}O_{2}(g)\xlongequal{}MgO(s)}$ $\Delta G_{3}=-570\ kJ/mol$
请书写一个方程式表示${NaBO_{2}}$再生为${NaBH_{4}}$的一种制备方法,并注明$\Delta G$
NaBO_2(s) + 2H_2O(l) + 4Mg(s) \xlongequal{} NaBH_4(s) + 4MgO(s) \Delta G = - 1000 kJ/mol[或 NaBO_2(s) + 2H_2(g) + 2Mg(s) \xlongequal{} NaBH_4(s) + 2MgO(s) \Delta G = -340 kJ/mol]
。(要求:反应物不超过三种物质;氢原子利用率为$100\%$)

答案:
(1)C
(2)AC
(3)随着投料比$\frac{n(NaBH_4)}{n(H_2O)} $的增大,$c(NaBH_4)$增大,$c(H_2O)$减小,ab 段生氢速率减小是由于$c(H_2O)$减小对速率的影响占主导
$(4)O_2 + 2CO_2 + 4e^- \xlongequal{} 2CO_3^{2-} 70\% $
$(5)NaBO_2(s) + 2H_2O(l) + 4Mg(s) \xlongequal{} NaBH_4(s) + 4MgO(s) $
$\Delta G = - 1000 kJ/mol[$或$ NaBO_2(s) + 2H_2(g) + 2Mg(s) \xlongequal{} NaBH_4(s) + 2MgO(s) \Delta G = -340 kJ/mol] $
【解析】化学反应原理综合
(1)该反应为放热且熵增的反应,任意温度下都能自发进行。
(2)升温可加快反应速率,A正确;$NaBH_4 $与水反应的实质是$BH_4^- $与水电离出的H^+ 反应,异丙胺是碱性物质,会消耗H^+,使反应速率减慢,B错误;硼酸是酸性物质,会产生H^+,使反应速率加快,C正确;反应物中没有气体,加压对反应速率没有影响,D错误。
(4)电池工作产生的电量为$3.2 × 10^{4} × 60 C = 2688 C,$氢气理论上失去的电子对应电量为$\frac{0.49}{24.5} × 2 × 6.0 × 10^{23} × 1.6 × 10^{-19} C = 3840 C,$转化率$=\frac{2688}{3840} × 100\% = 70\%。$
(5)由盖斯定律 -Ⅰ -4Ⅱ +4Ⅲ 或 -Ⅰ -2Ⅱ +2Ⅲ,写出$NaBO_2 $再生为$NaBH_4 $的制备方法。
(1)C
(2)AC
(3)随着投料比$\frac{n(NaBH_4)}{n(H_2O)} $的增大,$c(NaBH_4)$增大,$c(H_2O)$减小,ab 段生氢速率减小是由于$c(H_2O)$减小对速率的影响占主导
$(4)O_2 + 2CO_2 + 4e^- \xlongequal{} 2CO_3^{2-} 70\% $
$(5)NaBO_2(s) + 2H_2O(l) + 4Mg(s) \xlongequal{} NaBH_4(s) + 4MgO(s) $
$\Delta G = - 1000 kJ/mol[$或$ NaBO_2(s) + 2H_2(g) + 2Mg(s) \xlongequal{} NaBH_4(s) + 2MgO(s) \Delta G = -340 kJ/mol] $
【解析】化学反应原理综合
(1)该反应为放热且熵增的反应,任意温度下都能自发进行。
(2)升温可加快反应速率,A正确;$NaBH_4 $与水反应的实质是$BH_4^- $与水电离出的H^+ 反应,异丙胺是碱性物质,会消耗H^+,使反应速率减慢,B错误;硼酸是酸性物质,会产生H^+,使反应速率加快,C正确;反应物中没有气体,加压对反应速率没有影响,D错误。
(4)电池工作产生的电量为$3.2 × 10^{4} × 60 C = 2688 C,$氢气理论上失去的电子对应电量为$\frac{0.49}{24.5} × 2 × 6.0 × 10^{23} × 1.6 × 10^{-19} C = 3840 C,$转化率$=\frac{2688}{3840} × 100\% = 70\%。$
(5)由盖斯定律 -Ⅰ -4Ⅱ +4Ⅲ 或 -Ⅰ -2Ⅱ +2Ⅲ,写出$NaBO_2 $再生为$NaBH_4 $的制备方法。
查看更多完整答案,请扫码查看


