2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第30页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
4. 【传统文化】(2023·广东卷,2分)“高山流水觅知音”。下列中国古乐器中,主要由硅酸盐材料制成的是(

C
)
答案:
4.C 材料的分类 陶埙主要成分是硅酸盐,C正确。
5. (2023·湖北卷,3分)工业制备高纯硅的主要过程如下:
石英砂$\xrightarrow[1\ 800\sim2\ 000\ ^{\circ}C]{焦炭}$粗硅$\xrightarrow[300\ ^{\circ}C]{{HCl}}$${SiHCl_{3}}$$\xrightarrow[1\ 100\ ^{\circ}C]{{H_{2}}}$高纯硅
下列说法错误的是(
A.制备粗硅的反应方程式为${SiO_{2} + 2C\xlongequal{高温}Si + 2CO\uparrow}$
B.$1\ {mol}\ {Si}$含${Si—Si}$键的数目约为$4×6.02×10^{23}$
C.原料气${HCl}$和${H_{2}}$应充分去除水和氧气
D.生成${SiHCl_{3}}$的反应为熵减过程
石英砂$\xrightarrow[1\ 800\sim2\ 000\ ^{\circ}C]{焦炭}$粗硅$\xrightarrow[300\ ^{\circ}C]{{HCl}}$${SiHCl_{3}}$$\xrightarrow[1\ 100\ ^{\circ}C]{{H_{2}}}$高纯硅
下列说法错误的是(
B
)A.制备粗硅的反应方程式为${SiO_{2} + 2C\xlongequal{高温}Si + 2CO\uparrow}$
B.$1\ {mol}\ {Si}$含${Si—Si}$键的数目约为$4×6.02×10^{23}$
C.原料气${HCl}$和${H_{2}}$应充分去除水和氧气
D.生成${SiHCl_{3}}$的反应为熵减过程
答案:
5.B 制备高纯硅的流程分析 工业上常用焦炭还原石英砂制备粗硅,反应的化学方程式为SiO₂ + 2C$\stackrel{高温}{=\!=\!=}$Si + 2CO↑,A正确;制备的SiHCl₃易水解,生成的粗硅能被氧气氧化,则原料气HCl和H₂应充分除水和氧气,C正确;生成SiHCl₃的反应方程式为Si + 3HCl$\stackrel{300^{\circ}C}{=\!=\!=}$SiHCl₃ + H₂,反应前后气体分子数减少,属于熵减反应,D正确。
6. (2021·福建卷,4分)建盏是久负盛名的陶瓷茶器,承载着福建历史悠久的茶文化。关于建盏,下列说法错误的是(
A.高温烧结过程包含复杂的化学变化
B.具有耐酸碱腐蚀、不易变形的优点
C.制作所用的黏土原料是人工合成的
D.属硅酸盐产品,含有多种金属元素
C
)A.高温烧结过程包含复杂的化学变化
B.具有耐酸碱腐蚀、不易变形的优点
C.制作所用的黏土原料是人工合成的
D.属硅酸盐产品,含有多种金属元素
答案:
6.C 无机非金属材料 黏土多是天然物质,一般由硅酸盐矿物在地球表面风化后形成,C错误。
1. (2025·河北卷,15分)氢碘酸常用于合成碘化物。某化学兴趣小组用如图装置(夹持装置等略)制备氢碘酸。
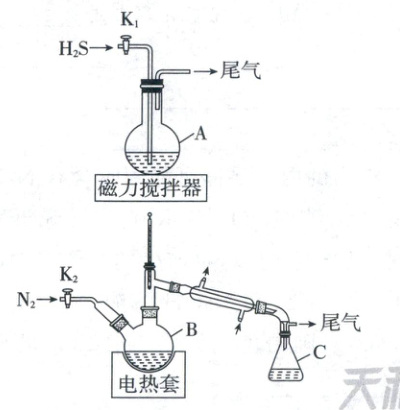
步骤如下:
ⅰ.在A中加入150 mL ${H_{2}O}$和127 g ${I_{2}}$,快速搅拌,打开${K_{1}}$通入${H_{2}S}$,反应完成后,关闭${K_{1}}$,静置、过滤得滤液;
ⅱ.将滤液转移至B中,打开${K_{2}}$通入${N_{2}}$,接通冷凝水,加热保持微沸,直至${H_{2}S}$除尽;
ⅲ.继续加热蒸馏,C中收集沸点为$125\sim 127\ ^{\circ}C$间的馏分,得到117 mL氢碘酸(密度为1.7 g/mL,HI质量分数为57%)。
回答下列问题:
(1)仪器A的名称:
(2)步骤ⅰ中快速搅拌的目的:
a.便于产物分离
b.防止暴沸
c.防止固体产物包覆碘
(3)步骤ⅰ中随着反应的进行,促进碘溶解的原因:
(4)步骤ⅱ中的尾气常用
(5)步骤ⅱ实验开始时的操作顺序:先通入${N_{2}}$,再加热。步骤ⅲ实验结束时相对应的操作顺序:
(6)列出本实验产率的计算表达式:
(7)氢碘酸见光易分解,易被空气氧化,应保存在

步骤如下:
ⅰ.在A中加入150 mL ${H_{2}O}$和127 g ${I_{2}}$,快速搅拌,打开${K_{1}}$通入${H_{2}S}$,反应完成后,关闭${K_{1}}$,静置、过滤得滤液;
ⅱ.将滤液转移至B中,打开${K_{2}}$通入${N_{2}}$,接通冷凝水,加热保持微沸,直至${H_{2}S}$除尽;
ⅲ.继续加热蒸馏,C中收集沸点为$125\sim 127\ ^{\circ}C$间的馏分,得到117 mL氢碘酸(密度为1.7 g/mL,HI质量分数为57%)。
回答下列问题:
(1)仪器A的名称:
圆底烧瓶
。通入${H_{2}S}$发生反应的化学方程式:$\mathrm{H_2S+I_2=2HI+S}$
。(2)步骤ⅰ中快速搅拌的目的:
c
(填序号)。a.便于产物分离
b.防止暴沸
c.防止固体产物包覆碘
(3)步骤ⅰ中随着反应的进行,促进碘溶解的原因:
$\mathrm{I^{-}+I_2\rightleftharpoons I_3^{-}}$
(用离子方程式表示)。(4)步骤ⅱ中的尾气常用
NaOH(合理即可)
(填化学式)溶液吸收。(5)步骤ⅱ实验开始时的操作顺序:先通入${N_{2}}$,再加热。步骤ⅲ实验结束时相对应的操作顺序:
先停止加热,再停止通入$\mathrm{N_2}$
。(6)列出本实验产率的计算表达式:
$\frac{117×1.7×57\%}{128×1}$×100%
。(7)氢碘酸见光易分解,易被空气氧化,应保存在
棕色细口试剂瓶中,且瓶口密封
。
答案:
1.(15分)
(1)圆底烧瓶 $\mathrm{H_2S+I_2=2HI+S}$
(2)c
(3)$\mathrm{I^{-}+I_2\rightleftharpoons I_3^{-}}$
(4)NaOH(合理即可)
(5)先停止加热,再停止通入$\mathrm{N_2}$
(6)$\frac{117×1.7×57\%}{128×1}$×100%
(7)棕色细口试剂瓶中,且瓶口密封
[实验剖析]实验目的:制备氢碘酸。
实验原理:$\mathrm{I_2+H_2S=2HI+S}$
实验步骤:步骤ⅰ,在圆底烧瓶中发生反应$\mathrm{I_2+H_2S=2HI+S}$,反应完成后,静置,过滤得到S沉淀和滤液;步骤ⅱ,将滤液转移到双口烧瓶中,在$\mathrm{N_2}$作用下除$\mathrm{H_2S}$;步骤ⅲ,蒸馏,收集125 - 127℃间的馏分,得到HI。
[解析]实验综合
(1)仪器A为圆底烧瓶;在圆底烧瓶中$\mathrm{I_2}$与$\mathrm{H_2S}$发生反应$\mathrm{I_2+H_2S=2HI+S}$。
(2)产物分离需静置之后过滤,与搅拌无关,a项错误;实验过程无需加热,所以不会暴沸,b项错误;快速搅拌可使生成的S沉淀均匀分散,以避免包裹反应物$\mathrm{I_2}$,阻碍反应继续发生,c项正确。
(3)由于反应生成的$\mathrm{I^{-}}$可与$\mathrm{I_2}$发生反应$\mathrm{I^{-}+I_2\rightleftharpoons I_3^{-}}$,可促进碘的溶解。
(4)步骤ⅱ产生的尾气为$\mathrm{H_2S}$,可用NaOH溶液或$\mathrm{CuSO_4}$溶液吸收。
(5)步骤ⅲ为$\mathrm{N_2}$保护下的蒸馏操作,结束时应先停止加热,再关闭$\mathrm{K_2}$,停止通入$\mathrm{N_2}$。
(6)产率=$\frac{实际产量}{理论产量}$×100%,氢碘酸的实际产量为$117×1.7×57\%$g,根据反应方程式,可知其理论产量为$\frac{127}{254}$×2×128g,所以其产率为$\frac{117×1.7×57\%}{1×128}$×100%。
(7)由于氢碘酸见光易分解,且易被氧化,所以应保存在棕色细口瓶中,且密封保存。
(1)圆底烧瓶 $\mathrm{H_2S+I_2=2HI+S}$
(2)c
(3)$\mathrm{I^{-}+I_2\rightleftharpoons I_3^{-}}$
(4)NaOH(合理即可)
(5)先停止加热,再停止通入$\mathrm{N_2}$
(6)$\frac{117×1.7×57\%}{128×1}$×100%
(7)棕色细口试剂瓶中,且瓶口密封
[实验剖析]实验目的:制备氢碘酸。
实验原理:$\mathrm{I_2+H_2S=2HI+S}$
实验步骤:步骤ⅰ,在圆底烧瓶中发生反应$\mathrm{I_2+H_2S=2HI+S}$,反应完成后,静置,过滤得到S沉淀和滤液;步骤ⅱ,将滤液转移到双口烧瓶中,在$\mathrm{N_2}$作用下除$\mathrm{H_2S}$;步骤ⅲ,蒸馏,收集125 - 127℃间的馏分,得到HI。
[解析]实验综合
(1)仪器A为圆底烧瓶;在圆底烧瓶中$\mathrm{I_2}$与$\mathrm{H_2S}$发生反应$\mathrm{I_2+H_2S=2HI+S}$。
(2)产物分离需静置之后过滤,与搅拌无关,a项错误;实验过程无需加热,所以不会暴沸,b项错误;快速搅拌可使生成的S沉淀均匀分散,以避免包裹反应物$\mathrm{I_2}$,阻碍反应继续发生,c项正确。
(3)由于反应生成的$\mathrm{I^{-}}$可与$\mathrm{I_2}$发生反应$\mathrm{I^{-}+I_2\rightleftharpoons I_3^{-}}$,可促进碘的溶解。
(4)步骤ⅱ产生的尾气为$\mathrm{H_2S}$,可用NaOH溶液或$\mathrm{CuSO_4}$溶液吸收。
(5)步骤ⅲ为$\mathrm{N_2}$保护下的蒸馏操作,结束时应先停止加热,再关闭$\mathrm{K_2}$,停止通入$\mathrm{N_2}$。
(6)产率=$\frac{实际产量}{理论产量}$×100%,氢碘酸的实际产量为$117×1.7×57\%$g,根据反应方程式,可知其理论产量为$\frac{127}{254}$×2×128g,所以其产率为$\frac{117×1.7×57\%}{1×128}$×100%。
(7)由于氢碘酸见光易分解,且易被氧化,所以应保存在棕色细口瓶中,且密封保存。
查看更多完整答案,请扫码查看


