2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第12页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
13. (2021·山东卷,4分,不定项)实验室中利用固体${KMnO_{4}}$进行如下实验,下列说法错误的是(
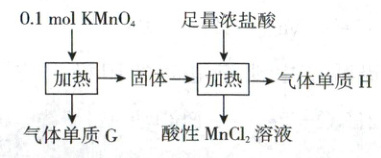
A.${G}$与${H}$均为氧化产物
B.实验中${KMnO_{4}}$只作氧化剂
C.${Mn}$元素至少参与了$3$个氧化还原反应
D.${G}$与${H}$的物质的量之和可能为$0.25\ mol$
BD
)
A.${G}$与${H}$均为氧化产物
B.实验中${KMnO_{4}}$只作氧化剂
C.${Mn}$元素至少参与了$3$个氧化还原反应
D.${G}$与${H}$的物质的量之和可能为$0.25\ mol$
答案:
13.BD 氧化还原反应
【信息转化】
$K^{+7}MnO_4\xlongequal{加热}O_2(G) K_2MnO_4、MnO_2$ 和 $O_2$,$KMnO_4$ 既作氧化剂又作还原剂,B 符合题意;由得失电子守恒可得 $0.1\ mol × (7 - 2) = n(O_2) × 4 + n(Cl_2) × 2$,则 $n(Cl_2) + 2n(O_2) = 0.25\ mol$,所以 $n(O_2) + n(Cl_2) < 0.25\ mol$,D 符合题意。
【信息转化】
$K^{+7}MnO_4\xlongequal{加热}O_2(G) K_2MnO_4、MnO_2$ 和 $O_2$,$KMnO_4$ 既作氧化剂又作还原剂,B 符合题意;由得失电子守恒可得 $0.1\ mol × (7 - 2) = n(O_2) × 4 + n(Cl_2) × 2$,则 $n(Cl_2) + 2n(O_2) = 0.25\ mol$,所以 $n(O_2) + n(Cl_2) < 0.25\ mol$,D 符合题意。
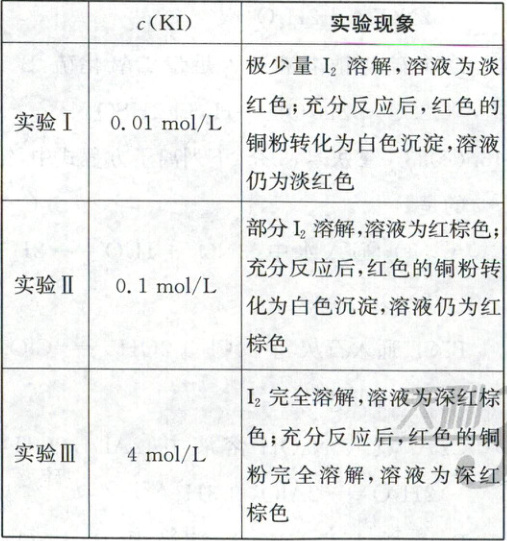
14. (2023·北京卷,14分)资料显示,${I_{2}}$可以将${Cu}$氧化为${Cu^{2+}}$。某小组同学设计实验探究${Cu}$被${I_{2}}$氧化的产物及铜元素的价态。
已知:${I_{2}}$易溶于${KI}$溶液,发生反应${I_{2} + I^-⇌ I^-_{3}}$(红棕色);${I_{2}}$和${I^-_{3}}$氧化性几乎相同。
(1)将等体积的${KI}$溶液加入到$m\ mol$铜粉和$n\ mol\ {I_{2}}(n > m)$的固体混合物中,振荡。
实验记录如下:
①初始阶段,${Cu}$被氧化的反应速率:实验Ⅰ
②实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有${[Cu(H_{2}O)_{4}]^{2+}}$(蓝色)或${[CuI_{2}]^-}$(无色),进行以下实验探究:
步骤a. 取实验Ⅲ的深红棕色溶液,加入${CCl_{4}}$,多次萃取、分液。
步骤b. 取分液后的无色水溶液,滴入浓氨水。
溶液颜色变浅蓝色,并逐渐变深。
ⅰ. 步骤a的目的是
ⅱ. 查阅资料,${2Cu^{2+} + 4I^-\xlongequal{}2CuI\downarrow + I_{2}}$,${[Cu(NH_{3})_{2}]^+}$(无色)容易被空气氧化。用离子方程式解释步骤b的溶液中发生的变化:
③结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是${CuI}$,实验Ⅰ中铜被氧化的化学方程式是
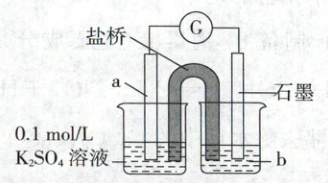
(2)上述实验结果,${I_{2}}$仅将${Cu}$氧化为$+1$价。在隔绝空气的条件下进行电化学实验,证实了${I_{2}}$能将${Cu}$氧化为${Cu^{2+}}$。装置如图所示,a、b分别是
(3)运用氧化还原反应规律,分析在上述实验中${Cu}$被${I_{2}}$氧化的产物中价态不同的原因:。
已知:${I_{2}}$易溶于${KI}$溶液,发生反应${I_{2} + I^-⇌ I^-_{3}}$(红棕色);${I_{2}}$和${I^-_{3}}$氧化性几乎相同。
(1)将等体积的${KI}$溶液加入到$m\ mol$铜粉和$n\ mol\ {I_{2}}(n > m)$的固体混合物中,振荡。
实验记录如下:
①初始阶段,${Cu}$被氧化的反应速率:实验Ⅰ
<
(填“$>$”“$<$”或“$=$”)实验Ⅱ。②实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有${[Cu(H_{2}O)_{4}]^{2+}}$(蓝色)或${[CuI_{2}]^-}$(无色),进行以下实验探究:
步骤a. 取实验Ⅲ的深红棕色溶液,加入${CCl_{4}}$,多次萃取、分液。
步骤b. 取分液后的无色水溶液,滴入浓氨水。
溶液颜色变浅蓝色,并逐渐变深。
ⅰ. 步骤a的目的是
排除 $I_3^-$ 的颜色对判断铜氧化产物的干扰
。ⅱ. 查阅资料,${2Cu^{2+} + 4I^-\xlongequal{}2CuI\downarrow + I_{2}}$,${[Cu(NH_{3})_{2}]^+}$(无色)容易被空气氧化。用离子方程式解释步骤b的溶液中发生的变化:
$[CuI_2]^- + 2NH_3 \longrightarrow [Cu(NH_3)_2]^+ + 2I^-$、$4[Cu(NH_3)_2]^+ + O_2 + 8NH_3 + 2H_2O \longrightarrow 4[Cu(NH_3)_4]^{2+} + 4OH^-$
。③结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是${CuI}$,实验Ⅰ中铜被氧化的化学方程式是
$2Cu + KI_3 \longrightarrow 2CuI + KI$
。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓${KI}$溶液,白色沉淀溶解
(填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是$I^-$ 浓度小,$CuI$ 覆盖在 $Cu$ 表面,阻止反应继续进行
。
(2)上述实验结果,${I_{2}}$仅将${Cu}$氧化为$+1$价。在隔绝空气的条件下进行电化学实验,证实了${I_{2}}$能将${Cu}$氧化为${Cu^{2+}}$。装置如图所示,a、b分别是
铜片、$I_2$ 和 $KI$ 的混合溶液
。
(3)运用氧化还原反应规律,分析在上述实验中${Cu}$被${I_{2}}$氧化的产物中价态不同的原因:。
答案:
14.(14 分)
(1)①$<$ ② i. 排除 $I_3^-$ 的颜色对判断铜氧化产物的干扰
ii.$[CuI_2]^- + 2NH_3 \longrightarrow [Cu(NH_3)_2]^+ + 2I^-$、$4[Cu(NH_3)_2]^+ + O_2 + 8NH_3 + 2H_2O \longrightarrow 4[Cu(NH_3)_4]^{2+} + 4OH^-$ ③$2Cu + KI_3 \longrightarrow 2CuI + KI$ 白色沉淀溶解 $I^-$ 浓度小,$CuI$ 覆盖在 $Cu$ 表面,阻止反应继续进行
(2)铜片、$I_2$ 和 $KI$ 的混合溶液
(3)电化学实验中,由于氧化性$\mathrm{I_2>Cu^{2+}}$,$\mathrm{I_2}$将$\mathrm{Cu}$氧化为$\mathrm{Cu^{2+}}$;实验$\mathrm{I\sim III}$,体系中有$\mathrm{I^-}$,生成$\mathrm{CuI}$或$[\mathrm{CuI_2}]^-$,使$+1$价铜的还原性减弱,$\mathrm{I_2}$不能氧化$\mathrm{CuI}$或$[\mathrm{CuI_2}]^-$
【解析】实验综合(1)①$\mathrm{I_2}$在水中溶解度很小,铜主要被$\mathrm{I_3^-}$氧化,初始阶段,实验Ⅱ中$\mathrm{I^-}$的浓度比实验Ⅰ中$\mathrm{I^-}$的浓度大,生成$\mathrm{I_3^-}$的速率更快,则实验Ⅱ中$\mathrm{Cu}$被氧化的速率更快。
②ⅰ.实验Ⅲ所得深红棕色溶液中存在平衡$\mathrm{I_2 + I^- \rightleftharpoons I_3^-}$,加入$\mathrm{CCl_4}$,多次萃取分液可以分离出溶液中的$\mathrm{I_2}$,使$\mathrm{I_2 + I^- \rightleftharpoons I_3^-}$的平衡不断逆向移动,最终可以除去溶液中红棕色的$\mathrm{I_3^-}$,防止干扰后续实验。ⅱ.结合查阅资料信息可知,实验Ⅲ所得溶液中,$\mathrm{Cu}$元素以无色的$[\mathrm{CuI_2}]^-$形式存在,加入浓氨水,发生反应:$[\mathrm{CuI_2}]^- + 2\mathrm{NH_3} = [\mathrm{Cu(NH_3)_2}]^+ + 2\mathrm{I^-}$,生成的$[\mathrm{Cu(NH_3)_2}]^+$又被氧气不断氧化为蓝色的$[\mathrm{Cu(NH_3)_4}]^{2+}$,发生反应:$4[\mathrm{Cu(NH_3)_2}]^+ + \mathrm{O_2} + 8\mathrm{NH_3} + 2\mathrm{H_2O} = 4[\mathrm{Cu(NH_3)_4}]^{2+} + 4\mathrm{OH^-}$。③若实验Ⅰ中生成的白色沉淀为$\mathrm{CuI}$,实验Ⅰ中$\mathrm{Cu}$被氧化的化学方程式为$2\mathrm{Cu} + \mathrm{KI_3} = 2\mathrm{CuI} + \mathrm{KI}$;分别取少量实验Ⅰ和实验Ⅱ中白色固体,洗涤后得到白色沉淀,由题意可知白色沉淀主要成分是$\mathrm{CuI}$,加入浓$\mathrm{KI}$溶液,发生反应$\mathrm{CuI} + \mathrm{I^- \rightleftharpoons [CuI_2]^-}$,则可以观察到的现象是白色沉淀溶解;铜未完全反应的原因是$\mathrm{I^-}$浓度小,生成的$\mathrm{CuI}$覆盖在铜表面,阻止反应进一步发生。(2)通过原电池装置证实$\mathrm{I_2}$可以将$\mathrm{Cu}$氧化为铜离子,则铜作负极,因为碘在水中溶解度很小,由已知信息可知碘的氧化性和$\mathrm{I_3^-}$几乎相同,则正极的电解质溶液可以是$\mathrm{I_2}$和$\mathrm{KI}$的混合溶液。
(1)①$<$ ② i. 排除 $I_3^-$ 的颜色对判断铜氧化产物的干扰
ii.$[CuI_2]^- + 2NH_3 \longrightarrow [Cu(NH_3)_2]^+ + 2I^-$、$4[Cu(NH_3)_2]^+ + O_2 + 8NH_3 + 2H_2O \longrightarrow 4[Cu(NH_3)_4]^{2+} + 4OH^-$ ③$2Cu + KI_3 \longrightarrow 2CuI + KI$ 白色沉淀溶解 $I^-$ 浓度小,$CuI$ 覆盖在 $Cu$ 表面,阻止反应继续进行
(2)铜片、$I_2$ 和 $KI$ 的混合溶液
(3)电化学实验中,由于氧化性$\mathrm{I_2>Cu^{2+}}$,$\mathrm{I_2}$将$\mathrm{Cu}$氧化为$\mathrm{Cu^{2+}}$;实验$\mathrm{I\sim III}$,体系中有$\mathrm{I^-}$,生成$\mathrm{CuI}$或$[\mathrm{CuI_2}]^-$,使$+1$价铜的还原性减弱,$\mathrm{I_2}$不能氧化$\mathrm{CuI}$或$[\mathrm{CuI_2}]^-$
【解析】实验综合(1)①$\mathrm{I_2}$在水中溶解度很小,铜主要被$\mathrm{I_3^-}$氧化,初始阶段,实验Ⅱ中$\mathrm{I^-}$的浓度比实验Ⅰ中$\mathrm{I^-}$的浓度大,生成$\mathrm{I_3^-}$的速率更快,则实验Ⅱ中$\mathrm{Cu}$被氧化的速率更快。
②ⅰ.实验Ⅲ所得深红棕色溶液中存在平衡$\mathrm{I_2 + I^- \rightleftharpoons I_3^-}$,加入$\mathrm{CCl_4}$,多次萃取分液可以分离出溶液中的$\mathrm{I_2}$,使$\mathrm{I_2 + I^- \rightleftharpoons I_3^-}$的平衡不断逆向移动,最终可以除去溶液中红棕色的$\mathrm{I_3^-}$,防止干扰后续实验。ⅱ.结合查阅资料信息可知,实验Ⅲ所得溶液中,$\mathrm{Cu}$元素以无色的$[\mathrm{CuI_2}]^-$形式存在,加入浓氨水,发生反应:$[\mathrm{CuI_2}]^- + 2\mathrm{NH_3} = [\mathrm{Cu(NH_3)_2}]^+ + 2\mathrm{I^-}$,生成的$[\mathrm{Cu(NH_3)_2}]^+$又被氧气不断氧化为蓝色的$[\mathrm{Cu(NH_3)_4}]^{2+}$,发生反应:$4[\mathrm{Cu(NH_3)_2}]^+ + \mathrm{O_2} + 8\mathrm{NH_3} + 2\mathrm{H_2O} = 4[\mathrm{Cu(NH_3)_4}]^{2+} + 4\mathrm{OH^-}$。③若实验Ⅰ中生成的白色沉淀为$\mathrm{CuI}$,实验Ⅰ中$\mathrm{Cu}$被氧化的化学方程式为$2\mathrm{Cu} + \mathrm{KI_3} = 2\mathrm{CuI} + \mathrm{KI}$;分别取少量实验Ⅰ和实验Ⅱ中白色固体,洗涤后得到白色沉淀,由题意可知白色沉淀主要成分是$\mathrm{CuI}$,加入浓$\mathrm{KI}$溶液,发生反应$\mathrm{CuI} + \mathrm{I^- \rightleftharpoons [CuI_2]^-}$,则可以观察到的现象是白色沉淀溶解;铜未完全反应的原因是$\mathrm{I^-}$浓度小,生成的$\mathrm{CuI}$覆盖在铜表面,阻止反应进一步发生。(2)通过原电池装置证实$\mathrm{I_2}$可以将$\mathrm{Cu}$氧化为铜离子,则铜作负极,因为碘在水中溶解度很小,由已知信息可知碘的氧化性和$\mathrm{I_3^-}$几乎相同,则正极的电解质溶液可以是$\mathrm{I_2}$和$\mathrm{KI}$的混合溶液。
查看更多完整答案,请扫码查看


