2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第70页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
13. (2024·北京卷,3分)苯在浓${HNO_{3}}$和浓${H_{2}SO_{4}}$作用下,反应过程中能量变化示意图如下。下列说法不正确的是(

A.从中间体到产物,无论从产物稳定性还是反应速率的角度均有利于产物Ⅱ
B.X为苯的加成产物,Y为苯的取代产物
C.由苯得到M时,苯中的大$\pi$键没有变化
D.对于生成Y的反应,浓${H_{2}SO_{4}}$作催化剂
C
)
A.从中间体到产物,无论从产物稳定性还是反应速率的角度均有利于产物Ⅱ
B.X为苯的加成产物,Y为苯的取代产物
C.由苯得到M时,苯中的大$\pi$键没有变化
D.对于生成Y的反应,浓${H_{2}SO_{4}}$作催化剂
答案:
13.C 有机化学与反应历程图 生成产物Ⅱ的反应的活化能更低,反应速率更快,且产物Ⅱ的能量更低即产物Ⅱ更稳定,以上2个角度均有利于产物Ⅱ,A正确;根据前后结构对照,X为苯的加成产物,Y为苯的取代产物,B正确;M的六元环中与—$NO_2$相连的C为$sp^3$杂化,苯中大$\pi$键发生改变,C错误;苯的硝化反应中浓$H_2SO_4$作催化剂,D正确。
知识拓展
大$\pi$键的形成条件
(1)所有参与离域$\pi$键的原子都必须在同一平面内,即连接这些原子的中心原子只能采取$sp$或$sp^2$杂化;
(2)所有参与离域$\pi$键的原子都必须提供一个或两个相互平行的p轨道;
(3)根据泡利不相容原理,参与离域$\pi$键的p轨道上的电子总数必须小于p轨道数的2倍。
知识拓展
大$\pi$键的形成条件
(1)所有参与离域$\pi$键的原子都必须在同一平面内,即连接这些原子的中心原子只能采取$sp$或$sp^2$杂化;
(2)所有参与离域$\pi$键的原子都必须提供一个或两个相互平行的p轨道;
(3)根据泡利不相容原理,参与离域$\pi$键的p轨道上的电子总数必须小于p轨道数的2倍。
14. (2024·贵州卷,3分)${AgCN}$与${CH_{3}CH_{2}Br}$可发生取代反应,反应过程中${CN^{-}}$的C原子和N原子均可进攻${CH_{3}CH_{2}Br}$,分别生成腈(${CH_{3}CH_{2}CN}$)和异腈(${CH_{3}CH_{2}NC}$)两种产物。通过量子化学计算得到的反应历程及能量变化如图(TS为过渡态,Ⅰ、Ⅱ为后续物)。
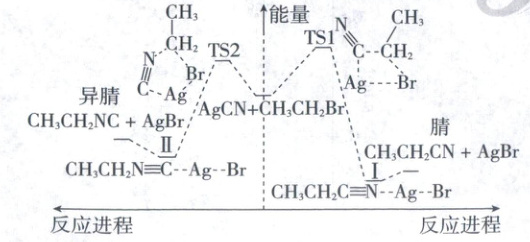
下列说法错误的是(
A.从${CH_{3}CH_{2}Br}$生成${CH_{3}CH_{2}CN}$和${CH_{3}CH_{2}NC}$的反应都是放热反应
B.过渡态TS1是由${CN^{-}}$的C原子进攻${CH_{3}CH_{2}Br}$的$\alpha - C$而形成的
C.Ⅰ中“${N - Ag}$”之间的作用力比Ⅱ中“${C - Ag}$”之间的作用力弱
D.生成${CH_{3}CH_{2}CN}$放热更多,低温时${CH_{3}CH_{2}CN}$是主要产物

下列说法错误的是(
D
)A.从${CH_{3}CH_{2}Br}$生成${CH_{3}CH_{2}CN}$和${CH_{3}CH_{2}NC}$的反应都是放热反应
B.过渡态TS1是由${CN^{-}}$的C原子进攻${CH_{3}CH_{2}Br}$的$\alpha - C$而形成的
C.Ⅰ中“${N - Ag}$”之间的作用力比Ⅱ中“${C - Ag}$”之间的作用力弱
D.生成${CH_{3}CH_{2}CN}$放热更多,低温时${CH_{3}CH_{2}CN}$是主要产物
答案:
14.D 反应原理历程图分析 由图可知,两个反应的产物能量均低于反应物,所以都是放热反应,A正确;根据图中过渡态TS1结构可知,TS1是由$CN^-$中的C原子进攻$CH_3CH_2Br$的$\alpha$-C而形成的,B正确;由图可知,断开Ⅰ中“N—Ag”吸收的能量较断开Ⅱ中“C—Ag”吸收的能量小,故后者作用力更强,C正确;两个反应为竞争反应,反应未平衡时,哪种产物更多取决于两个反应的反应速率大小,生成$CH_3CH_2NC$的反应活化能更小,速率更快,故$CH_3CH_2NC$是主要产物,D错误。
15. (2023·江苏卷,3分)金属硫化物(${M_{x}S_{y}}$)催化反应 ${CH_{4}(g) + 2H_{2}S(g) = CS_{2}(g) + 4H_{2}(g)}$,既可以除去天然气中的${H_{2}S}$,又可以获得${H_{2}}$。下列说法正确的是(

A.该反应的$\Delta S < 0$
B.该反应的平衡常数 $K = \frac{c({CH_{4}}) · c^{2}({H_{2}S})}{c({CS_{2}}) · c^{4}({H_{2}})}$
C.如图所示的反应机理中,步骤Ⅰ可理解为${H_{2}S}$中带部分负电荷的S与催化剂中的M之间发生作用
D.该反应中每消耗1 mol ${H_{2}S}$,转移电子的数目约为$2 × 6.02 × 10^{23}$
C
)
A.该反应的$\Delta S < 0$
B.该反应的平衡常数 $K = \frac{c({CH_{4}}) · c^{2}({H_{2}S})}{c({CS_{2}}) · c^{4}({H_{2}})}$
C.如图所示的反应机理中,步骤Ⅰ可理解为${H_{2}S}$中带部分负电荷的S与催化剂中的M之间发生作用
D.该反应中每消耗1 mol ${H_{2}S}$,转移电子的数目约为$2 × 6.02 × 10^{23}$
答案:
15.C 由方程式分析熵变、平衡常数及电子转移 该反应$\Delta S>0$,A错误;平衡常数表达式为$K=\frac{c(CS_2)· c^4(H_2)}{c(CH_4)· c^2(H_2S)}$,B错误;由方程式可知,1mol$H_2S$参加反应转移4$N_A$个电子,D错误。
16. (2022·1月浙江卷,2分)某课题组设计一种固定${CO_{2}}$的方法,原理如图。下列说法不正确的是(

A.反应原料中的原子100%转化为产物
B.该过程在化合物X和${I^{-}}$催化下完成
C.该过程仅涉及加成反应
D.若原料用 ,则产物为
,则产物为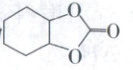
C
)
A.反应原料中的原子100%转化为产物
B.该过程在化合物X和${I^{-}}$催化下完成
C.该过程仅涉及加成反应
D.若原料用
 ,则产物为
,则产物为
答案:
16.C 化学反应历程分析 分析反应机理图示可知,反应物为二氧化碳和 ,最终生成物为 ,没有其他物质生成,反应原料中的原子100%转化为产物,A正确;通过图示可知,化合物X和Ⅰ在反应过程中参与了反应,又重新生成,是该反应的催化剂,B正确;在该循环过程中最后生成 的过程为取代反应,C错误;分析该反应流程可知,通过该历程可以把三元环转化为五元环,故若原料用
的过程为取代反应,C错误;分析该反应流程可知,通过该历程可以把三元环转化为五元环,故若原料用 ,则产物为
,则产物为 ,D正确。
,D正确。
16.C 化学反应历程分析 分析反应机理图示可知,反应物为二氧化碳和 ,最终生成物为 ,没有其他物质生成,反应原料中的原子100%转化为产物,A正确;通过图示可知,化合物X和Ⅰ在反应过程中参与了反应,又重新生成,是该反应的催化剂,B正确;在该循环过程中最后生成
 的过程为取代反应,C错误;分析该反应流程可知,通过该历程可以把三元环转化为五元环,故若原料用
的过程为取代反应,C错误;分析该反应流程可知,通过该历程可以把三元环转化为五元环,故若原料用 ,则产物为
,则产物为 ,D正确。
,D正确。 查看更多完整答案,请扫码查看


