2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第85页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
5. (2025 · 甘肃卷,3 分) 氨基乙酸(${NH_{2}CH_{2}COOH}$)是结构最简单的氨基酸分子,其分子在水溶液中存在如下平衡:
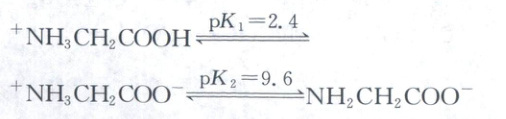
在$25\ ^{\circ}C$时,其分布分数$\delta\ \left[如\right.$
$\delta({NH_{2}CH_{2}COO^{-}})=$$\dfrac{c({NH_{2}CH_{2}COO^{-}})}{c({^{+}NH_{3}CH_{2}COOH})+c({^{+}NH_{3}CH_{2}COO^{-}})+c({NH_{2}CH_{2}COO^{-}})}\left. \right]$
与溶液pH关系如图上方所示。在100 mL $0.01\ mol/L\ {^{+}NH_{3}CH_{2}COOH· Cl^{-}}$溶液中逐滴滴入0.1 mol/L ${NaOH}$溶液,溶液pH与${NaOH}$溶液滴入体积的变化关系如图下方所示。下列说法错误的是 (
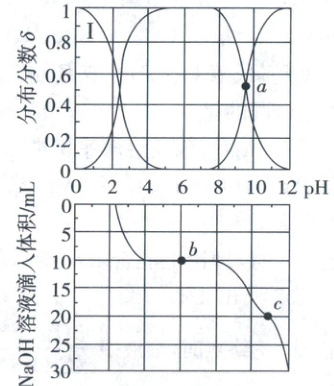
A.曲线Ⅰ对应的离子是${^{+}NH_{3}CH_{2}COOH}$
B.$a$点处对应的pH为9.6
C.$b$点处$c({^{+}NH_{3}CH_{2}COOH})=c({NH_{2}CH_{2}COO^{-}})$
D.$c$点处$2c({^{+}NH_{3}CH_{2}COOH})+c({^{+}NH_{3}CH_{2}COO^{-}})+c({H^{+}})=c({OH^{-}})$
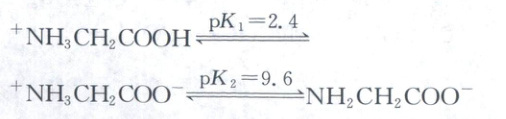
在$25\ ^{\circ}C$时,其分布分数$\delta\ \left[如\right.$
$\delta({NH_{2}CH_{2}COO^{-}})=$$\dfrac{c({NH_{2}CH_{2}COO^{-}})}{c({^{+}NH_{3}CH_{2}COOH})+c({^{+}NH_{3}CH_{2}COO^{-}})+c({NH_{2}CH_{2}COO^{-}})}\left. \right]$
与溶液pH关系如图上方所示。在100 mL $0.01\ mol/L\ {^{+}NH_{3}CH_{2}COOH· Cl^{-}}$溶液中逐滴滴入0.1 mol/L ${NaOH}$溶液,溶液pH与${NaOH}$溶液滴入体积的变化关系如图下方所示。下列说法错误的是 (
C
)
A.曲线Ⅰ对应的离子是${^{+}NH_{3}CH_{2}COOH}$
B.$a$点处对应的pH为9.6
C.$b$点处$c({^{+}NH_{3}CH_{2}COOH})=c({NH_{2}CH_{2}COO^{-}})$
D.$c$点处$2c({^{+}NH_{3}CH_{2}COOH})+c({^{+}NH_{3}CH_{2}COO^{-}})+c({H^{+}})=c({OH^{-}})$
答案:
5.C 电解质溶液曲线分析 随着溶液pH增大,$+NH_3CH_2COOH$的分布分数逐渐减小,$+NH_3CH_2COO^-$的分布分数先增大后减小,$NH_2CH_2COO^-$的分布分数逐渐增大,则曲线Ⅰ对应的离子是$+NH_3CH_2COOH$,A正确;由图像可知a点处$\delta(+NH_3CH_2COO^-)=\delta(NH_2CH_2COO^-)$,$K_a2=\frac{c(NH_2CH_2COO^-)· c(H^+)}{c(+NH_3CH_2COO^-)}=c(H^+)=10^{-9.6} mol/L$,对应的pH为9.6,B正确;b点处滴入$NaOH$溶液的体积为$10 mL$,溶液的溶质为等浓度的$+NH_3CH_2COO^-$和$NaCl$,$+NH_3CH_2COO^-$的电离常数$K_a1=10^{-9.6}$,$+NH_3CH_2COO^-$的水解常数$K_h2=\frac{K_w}{K_a1}=\frac{10^{-14}}{10^{-2.4}}=10^{-11.6}$,$+NH_3CH_2COO^-$的电离程度大于其水解程度,则$c(+NH_3CH_2COOH)<c(NH_2CH_2COO^-)$,C错误;c点处滴入$NaOH$溶液的体积为$20 mL$,溶液的溶质为等浓度的$NH_2CH_2COONa$和$NaCl$,溶液中存在质子守恒$2c(+NH_3CH_2COOH)+c(+NH_3CH_2COO^-)+c(H^+)=c(OH^-)$,D正确。
6. (2025·河北卷,3分)已知${Cu^{2+}}$和${L^{3-}}$结合形成两种配离子${[CuL]^{-}}$和${[CuL_{2}]^{4-}}$。常温下,0.100 mol/L的${H_{3}L}$和0.002 mol/L的${CuSO_{4}}$混合溶液中,${HL^{2-}}$和${L^{3-}}$的浓度对数$\lg c$(实线)、含铜微粒的分布系数$\delta$(虚线)[例如$\delta_{{Cu^{2+}}}=\dfrac{c({Cu^{2+}})}{c({Cu^{2+}})+c({[CuL]^{-}})+c({[CuL_{2}]^{4-}})}$]与溶液pH的关系如图所示:
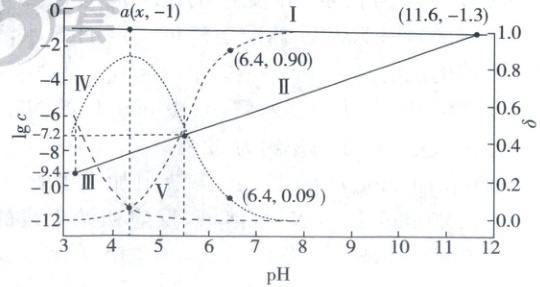
下列说法错误的是 (
A.${Cu^{2+} + L^{3-}⇌ [CuL]^{-}}$,$K=10^{9.4}$
B.${HL^{2-}⇌ H^{+} + L^{3-}}$,$K=10^{-11.6}$
C.图中$a$点对应的${pH=4.2}$
D.当${pH=6.4}$时,体系中$c({HL^{2-}})>c({[CuL_{2}]^{4-}})>c({[CuL]^{-}})>c({L^{3-}})$

下列说法错误的是 (
C
)A.${Cu^{2+} + L^{3-}⇌ [CuL]^{-}}$,$K=10^{9.4}$
B.${HL^{2-}⇌ H^{+} + L^{3-}}$,$K=10^{-11.6}$
C.图中$a$点对应的${pH=4.2}$
D.当${pH=6.4}$时,体系中$c({HL^{2-}})>c({[CuL_{2}]^{4-}})>c({[CuL]^{-}})>c({L^{3-}})$
答案:
6.C 溶液中的离子反应与平衡
【图像分析】
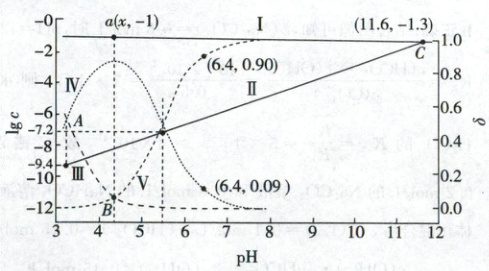
实线描述的是$HL^-$和$L^{3-}$的浓度对数与pH关系曲线,随pH升高$HL^- \rightleftharpoons H^+ + L^{3-}$平衡正向移动,$L^{3-}$浓度增大,$HL^-$浓度降低,因此Ⅰ代表$HL^-$,Ⅱ代表$L^{3-}$。虚线为$Cu^{2+}$、$[CuL]^-$、$[CuL_2]^{4-}$分布系数与pH关系曲线,反应过程为A.$Cu^{2+} + L^{3-} \rightleftharpoons [CuL]^-$,B.$[CuL]^- + L^{3-} \rightleftharpoons [CuL_2]^{4-}$,随pH升高,$L^{3-}$浓度增大,A正向移动,$[CuL]^-$浓度升高,继续升高$L^{3-}$浓度,B正向移动,$[CuL_2]^{4-}$浓度升高,整个过程中$Cu^{2+}$浓度持续降低,因此Ⅲ、Ⅳ、Ⅴ分别对应$Cu^{2+}$、$[CuL]^-$、$[CuL_2]^{4-}$。
$Cu^{2+} + L^{3-} \rightleftharpoons [CuL]^-$中$K=\frac{c([CuL]^-)}{c(Cu^{2+})· c(L^{3-})}$,在图像中找到Ⅲ、Ⅳ线交点A,对应$L^{3-}$浓度为$10^{-9.4} mol/L$,因此$K=10^{9.4}$,A正确;同理,找到Ⅰ、Ⅱ的交点C(此时$HL^-$和$L^{3-}$的浓度相等),pH=11.6,代入$HL^- \rightleftharpoons H^+ + L^{3-}$,$K=\frac{c(H^+)· c(L^{3-})}{c(HL^{2-})}=10^{-11.6}$,B正确;A.$Cu^{2+} + L^{3-} \rightleftharpoons [CuL]^-$ $K=\frac{c([CuL]^-)}{c(Cu^{2+})· c(L^{3-})}=10^{8.4}$,B.$[CuL]^- + L^{3-} \rightleftharpoons [CuL_2]^{4-}$ $K=\frac{c([CuL_2]^{4-})}{c([CuL]^-)· c(L^{3-})}=10^{7.2}$,反应A+反应B对应的$K_总=\frac{c([CuL_2]^{4-})}{c(Cu^{2+})· c^2(L^{3-})}=10^{16.6}$,找到B点,$Cu^{2+}$、$[CuL_2]^{4-}$浓度相等,可求得$c(L^{3-})=10^{-8.3} mol/L$,由a点可知,$HL^-$浓度为$0.1 mol/L$,代入$K=\frac{c(H^+)· c(L^{3-})}{c(HL^{2-})}=10^{-11.6}$可求得$c(H^+)=10^{-4.3} mol/L$,pH=4.3,C错误;当pH=6.4时,经计算可知$c\{[CuL_2]^{4-}\}=0.002×0.9 mol/L>c\{[CuL]^-\}=0.002×0.09 mol/L$,代入B反应的K可算出$c(L^{3-})=10^{-6.2} mol/L$,代入B项中的K值算出$c(HL^-)=0.1 mol/L$,D正确。
6.C 溶液中的离子反应与平衡
【图像分析】

实线描述的是$HL^-$和$L^{3-}$的浓度对数与pH关系曲线,随pH升高$HL^- \rightleftharpoons H^+ + L^{3-}$平衡正向移动,$L^{3-}$浓度增大,$HL^-$浓度降低,因此Ⅰ代表$HL^-$,Ⅱ代表$L^{3-}$。虚线为$Cu^{2+}$、$[CuL]^-$、$[CuL_2]^{4-}$分布系数与pH关系曲线,反应过程为A.$Cu^{2+} + L^{3-} \rightleftharpoons [CuL]^-$,B.$[CuL]^- + L^{3-} \rightleftharpoons [CuL_2]^{4-}$,随pH升高,$L^{3-}$浓度增大,A正向移动,$[CuL]^-$浓度升高,继续升高$L^{3-}$浓度,B正向移动,$[CuL_2]^{4-}$浓度升高,整个过程中$Cu^{2+}$浓度持续降低,因此Ⅲ、Ⅳ、Ⅴ分别对应$Cu^{2+}$、$[CuL]^-$、$[CuL_2]^{4-}$。
$Cu^{2+} + L^{3-} \rightleftharpoons [CuL]^-$中$K=\frac{c([CuL]^-)}{c(Cu^{2+})· c(L^{3-})}$,在图像中找到Ⅲ、Ⅳ线交点A,对应$L^{3-}$浓度为$10^{-9.4} mol/L$,因此$K=10^{9.4}$,A正确;同理,找到Ⅰ、Ⅱ的交点C(此时$HL^-$和$L^{3-}$的浓度相等),pH=11.6,代入$HL^- \rightleftharpoons H^+ + L^{3-}$,$K=\frac{c(H^+)· c(L^{3-})}{c(HL^{2-})}=10^{-11.6}$,B正确;A.$Cu^{2+} + L^{3-} \rightleftharpoons [CuL]^-$ $K=\frac{c([CuL]^-)}{c(Cu^{2+})· c(L^{3-})}=10^{8.4}$,B.$[CuL]^- + L^{3-} \rightleftharpoons [CuL_2]^{4-}$ $K=\frac{c([CuL_2]^{4-})}{c([CuL]^-)· c(L^{3-})}=10^{7.2}$,反应A+反应B对应的$K_总=\frac{c([CuL_2]^{4-})}{c(Cu^{2+})· c^2(L^{3-})}=10^{16.6}$,找到B点,$Cu^{2+}$、$[CuL_2]^{4-}$浓度相等,可求得$c(L^{3-})=10^{-8.3} mol/L$,由a点可知,$HL^-$浓度为$0.1 mol/L$,代入$K=\frac{c(H^+)· c(L^{3-})}{c(HL^{2-})}=10^{-11.6}$可求得$c(H^+)=10^{-4.3} mol/L$,pH=4.3,C错误;当pH=6.4时,经计算可知$c\{[CuL_2]^{4-}\}=0.002×0.9 mol/L>c\{[CuL]^-\}=0.002×0.09 mol/L$,代入B反应的K可算出$c(L^{3-})=10^{-6.2} mol/L$,代入B项中的K值算出$c(HL^-)=0.1 mol/L$,D正确。
查看更多完整答案,请扫码查看


