2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第84页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
1. (2025·辽吉黑内蒙古卷,3分)室温下,将0.1 mol AgCl置于0.1 mol/L ${NH_{4}NO_{3}}$溶液中,保持溶液体积和N元素总物质的量不变,pX - pH曲线如图,${Ag^{+} + NH_{3}⇌ [Ag(NH_{3})]^{+}}$和${Ag^{+} + 2NH_{3}⇌ [Ag(NH_{3})_{2}]^{+}}$的平衡常数分别为$K_{1}$和$K_{2}$;${NH^{+}_{4}}$的水解常数$K_{h}({NH^{+}_{4}})=10^{-9.25}$。下列说法错误的是 (
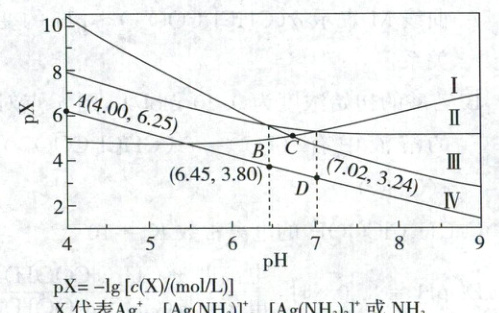
${pX=-\lg [c(X)/(mol/L)]}$
${X}$代表${Ag^{+}}$、${[Ag(NH_{3})]^{+}}$、${[Ag(NH_{3})_{2}]^{+}}$或${NH_{3}}$
A.Ⅲ为${[Ag(NH_{3})_{2}]^{+}}$的变化曲线
B.D点:$c({NH^{+}_{4}})-c({OH^{-}})>0.1-c({H^{+}})$
C.$K_{1}=10^{3.24}$
D.C点:$c({NH_{3}})=10^{-3.52}\ mol/L$
B
)
${pX=-\lg [c(X)/(mol/L)]}$
${X}$代表${Ag^{+}}$、${[Ag(NH_{3})]^{+}}$、${[Ag(NH_{3})_{2}]^{+}}$或${NH_{3}}$
A.Ⅲ为${[Ag(NH_{3})_{2}]^{+}}$的变化曲线
B.D点:$c({NH^{+}_{4}})-c({OH^{-}})>0.1-c({H^{+}})$
C.$K_{1}=10^{3.24}$
D.C点:$c({NH_{3}})=10^{-3.52}\ mol/L$
答案:
1.B 电解质溶液曲线
【图像分析】随着pH的增大,$c(NH_3)$逐渐增大,使得$Ag^+ + NH_3 \rightleftharpoons [Ag(NH_3)]^+$和$Ag^+ + 2NH_3 \rightleftharpoons [Ag(NH_3)_2]^+$的平衡正向移动,则$c(Ag^+)$逐渐减小,$c\{[Ag(NH_3)]^+\}$先增大后减小,$c\{[Ag(NH_3)_2]^+\}$逐渐增大,由$NH_4^+$的水解常数$K_h(NH_4^+)=10^{-9.25}$可知,Ⅳ为$p(NH_3)$随pH的变化曲线。
D点$c(NH_4^+)<0.1 mol/L$,$c(OH^-)>c(H^+)$,则$c(NH_4^+)-c(OH^-)<0.1 - c(H^+)$,B错误;由图像可知,当溶液的pH=7.02时,$p(Ag^+)=p\{[Ag(NH_3)]^+\}$,$p(NH_3)=3.24$,则$K_1=\frac{c\{[Ag(NH_3)]^+\}}{c(Ag^+)· c(NH_3)}=\frac{1}{c(NH_3)}=10^{3.24}$,C正确;由图像可知,当溶液的pH=6.45时,$p\{[Ag(NH_3)_2]^+\}=p\{[Ag(NH_3)]^+\}$,$p(NH_3)=3.80$,则$[Ag(NH_3)]^+ + NH_3 \rightleftharpoons [Ag(NH_3)_2]^+$的平衡常数$K=\frac{c\{[Ag(NH_3)_2]^+\}}{c\{[Ag(NH_3)]^+\}· c(NH_3)}=\frac{1}{c(NH_3)}=10^{3.80}$,则$Ag^+ + 2NH_3 \rightleftharpoons [Ag(NH_3)_2]^+$的平衡常数$K_2=K· K_1=10^{7.04}$,由图像可知C点$p(Ag^+)=p\{[Ag(NH_3)_2]^+\}$,则$K_2=\frac{c\{[Ag(NH_3)_2]^+\}}{c(Ag^+)· c^2(NH_3)}=\frac{1}{c^2(NH_3)}=10^{7.04}$,则$c(NH_3)=10^{-3.52} mol/L$,D正确。
1.B 电解质溶液曲线
【图像分析】随着pH的增大,$c(NH_3)$逐渐增大,使得$Ag^+ + NH_3 \rightleftharpoons [Ag(NH_3)]^+$和$Ag^+ + 2NH_3 \rightleftharpoons [Ag(NH_3)_2]^+$的平衡正向移动,则$c(Ag^+)$逐渐减小,$c\{[Ag(NH_3)]^+\}$先增大后减小,$c\{[Ag(NH_3)_2]^+\}$逐渐增大,由$NH_4^+$的水解常数$K_h(NH_4^+)=10^{-9.25}$可知,Ⅳ为$p(NH_3)$随pH的变化曲线。

D点$c(NH_4^+)<0.1 mol/L$,$c(OH^-)>c(H^+)$,则$c(NH_4^+)-c(OH^-)<0.1 - c(H^+)$,B错误;由图像可知,当溶液的pH=7.02时,$p(Ag^+)=p\{[Ag(NH_3)]^+\}$,$p(NH_3)=3.24$,则$K_1=\frac{c\{[Ag(NH_3)]^+\}}{c(Ag^+)· c(NH_3)}=\frac{1}{c(NH_3)}=10^{3.24}$,C正确;由图像可知,当溶液的pH=6.45时,$p\{[Ag(NH_3)_2]^+\}=p\{[Ag(NH_3)]^+\}$,$p(NH_3)=3.80$,则$[Ag(NH_3)]^+ + NH_3 \rightleftharpoons [Ag(NH_3)_2]^+$的平衡常数$K=\frac{c\{[Ag(NH_3)_2]^+\}}{c\{[Ag(NH_3)]^+\}· c(NH_3)}=\frac{1}{c(NH_3)}=10^{3.80}$,则$Ag^+ + 2NH_3 \rightleftharpoons [Ag(NH_3)_2]^+$的平衡常数$K_2=K· K_1=10^{7.04}$,由图像可知C点$p(Ag^+)=p\{[Ag(NH_3)_2]^+\}$,则$K_2=\frac{c\{[Ag(NH_3)_2]^+\}}{c(Ag^+)· c^2(NH_3)}=\frac{1}{c^2(NH_3)}=10^{7.04}$,则$c(NH_3)=10^{-3.52} mol/L$,D正确。
2. 【生产环保】(2025·江苏卷,3分)室温下,有色金属冶炼废渣(含${Cu}$、${Ni}$、${Si}$等的氧化物)用过量的较浓${H_{2}SO_{4}}$溶液酸浸后,提取铜和镍的过程如图所示。
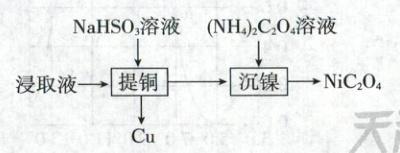
已知:$K_{a}({HSO^{-}_{4}})=1.2× 10^{-2}$,$K_{a1}({H_{2}SO_{3}})=1.2× 10^{-2}$,$K_{a2}({H_{2}SO_{3}})=6.0× 10^{-8}$。下列说法正确的是 (
A.较浓${H_{2}SO_{4}}$溶液中:$c({H^{+}})=2c({SO^{2-}_{4}})+c({OH^{-}})$
B.${NaHSO_{3}}$溶液中:${2HSO^{-}_{3}⇌ SO^{2-}_{3} + H_{2}SO_{3}}$的平衡常数$K=5.0× 10^{-6}$
C.${(NH_{4})_{2}C_{2}O_{4}}$溶液中:$c({NH_{3}· H_{2}O})+c({OH^{-}})=c({H_{2}C_{2}O_{4}})+c({HC_{2}O^{-}_{4}})+c({H^{+}})$
D.“提铜”和“沉镍”后的两份滤液中:$c_{提铜}({Na^{+}})=c_{沉镍}({Na^{+}})$

已知:$K_{a}({HSO^{-}_{4}})=1.2× 10^{-2}$,$K_{a1}({H_{2}SO_{3}})=1.2× 10^{-2}$,$K_{a2}({H_{2}SO_{3}})=6.0× 10^{-8}$。下列说法正确的是 (
B
)A.较浓${H_{2}SO_{4}}$溶液中:$c({H^{+}})=2c({SO^{2-}_{4}})+c({OH^{-}})$
B.${NaHSO_{3}}$溶液中:${2HSO^{-}_{3}⇌ SO^{2-}_{3} + H_{2}SO_{3}}$的平衡常数$K=5.0× 10^{-6}$
C.${(NH_{4})_{2}C_{2}O_{4}}$溶液中:$c({NH_{3}· H_{2}O})+c({OH^{-}})=c({H_{2}C_{2}O_{4}})+c({HC_{2}O^{-}_{4}})+c({H^{+}})$
D.“提铜”和“沉镍”后的两份滤液中:$c_{提铜}({Na^{+}})=c_{沉镍}({Na^{+}})$
答案:
2.B 工艺流程、溶液中的离子平衡 较浓硫酸中$K_a1(HSO_4^-)=1.2×10^{-2}$,$H_2SO_4 \rightleftharpoons HSO_4^- + H^+$,$HSO_4^- \rightleftharpoons H^+ + SO_4^{2-}$,硫酸第二步电离是部分电离,因此硫酸中还含有$HSO_4^-$,A中电荷守恒缺少$HSO_4^-$,A错误;$2HSO_3 \rightleftharpoons SO_3^{2-} + H_2SO_3$的平衡常数$K=\frac{c(SO_3^{2-})· c(H_2SO_3)}{c^2(HSO_3^-)}=\frac{K_a2}{K_a1}=\frac{6.0×10^{-8}}{1.2×10^{-2}}=5.0×10^{-6}$,B正确;$(NH_4)_2C_2O_4$溶液中存在电荷守恒$c(H^+)+c(NH_4^+)=c(HC_2O_4^-)+2c(C_2O_4^{2-})+c(OH^-)$,物料守恒$c(NH_4^+)+c(NH_3·H_2O)=2[c(H_2C_2O_4)+c(HC_2O_4^-)+c(C_2O_4^{2-})]$,由此推出$c(NH_3·H_2O)+c(OH^-)=2c(H_2C_2O_4)+c(HC_2O_4^-)+c(H^+)$,C错误;由于在“提铜”和“沉镍”过程中两次加入溶液,溶液总体积发生变化,因此$c_提铜(Na^+)$与$c_沉镍(Na^+)$不相等,D错误。
3. (2025·湖北卷,3分)铜(Ⅰ)、乙腈(简写为L)的某水溶液体系中含铜物种的分布曲线如图。纵坐标($\delta$)为含铜物种占总铜的物质的量分数,总铜浓度为$1.0× 10^{-3}\ mol/L$。下列描述正确的是 (
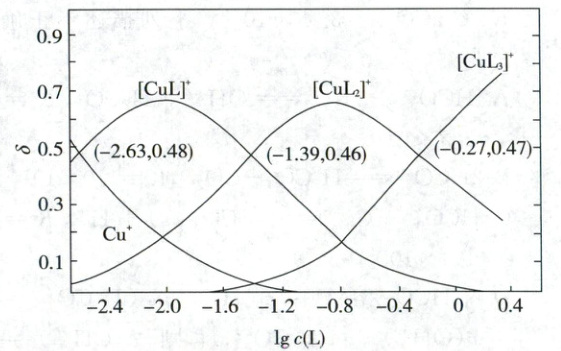
A.${Cu^{+} + 3L⇌ [CuL_{3}]^{+}}$的$\lg K=0.27$
B.当$c({Cu^{+}})=c\{[{CuL}]^{+}\}$时,$c\{[{CuL_{2}}]^{+}\}=2.0× 10^{-4}\ mol/L$
C.$n$从0增加到2,${[CuL_{n}]^{+}}$结合L的能力随之减小
D.若$c\{[{CuL}]^{+}\}=c\{[{CuL_{3}}]^{+}\}$,则$2c\{[{CuL_{2}}]^{+}\}<c\{[{CuL}]^{+}\}+3c\{[{CuL_{3}}]^{+}\}$
C
)
A.${Cu^{+} + 3L⇌ [CuL_{3}]^{+}}$的$\lg K=0.27$
B.当$c({Cu^{+}})=c\{[{CuL}]^{+}\}$时,$c\{[{CuL_{2}}]^{+}\}=2.0× 10^{-4}\ mol/L$
C.$n$从0增加到2,${[CuL_{n}]^{+}}$结合L的能力随之减小
D.若$c\{[{CuL}]^{+}\}=c\{[{CuL_{3}}]^{+}\}$,则$2c\{[{CuL_{2}}]^{+}\}<c\{[{CuL}]^{+}\}+3c\{[{CuL_{3}}]^{+}\}$
答案:
3.C 溶液中的离子平衡
【图像分析】由图像交点知①$Cu^+ + L \rightleftharpoons [CuL]^+$,$K_1=10^{2.63}$;②$[CuL]^+ + L \rightleftharpoons [CuL_2]$,$K_2=10^{1.39}$;③$[CuL_2]^+ + L \rightleftharpoons [CuL_3]^+$,$K_3=10^{0.27}$。
目标反应=①+②+③,该反应的$\lg K = 4.29$,A错误;$c(Cu^+)=c\{[CuL]^+\}$时,两者分布分数均为0.48,则$c\{[CuL_2]^+\}\approx0.04×1×10^{-3} mol/L=4×10^{-5} mol/L$,B错误;$K_1>K_2>K_3$,n越大,$[CuL_n]^+$结合L的能力越弱,C正确;②+③得$[CuL]^+ + 2L \rightleftharpoons [CuL_3]^+$,$K=10^{1.66}$,当$c\{[CuL]^+\}=c\{[CuL_3]^+\}$时,$c(L)=10^{-0.83} mol/L$,$K_3=\frac{c\{[CuL_3]^+\}}{c\{[CuL_2]^+\}× c(L)}=10^{0.27}$,$c\{[CuL_3]^+\}=c\{[CuL_2]^+\}×10^{-0.56}\approx0.3c\{[CuL_2]^+\}$,$2c\{[CuL_2]^+\}>c\{[CuL]^+\}+3c\{[CuL_3]^+\}$,D错误。
【图像分析】由图像交点知①$Cu^+ + L \rightleftharpoons [CuL]^+$,$K_1=10^{2.63}$;②$[CuL]^+ + L \rightleftharpoons [CuL_2]$,$K_2=10^{1.39}$;③$[CuL_2]^+ + L \rightleftharpoons [CuL_3]^+$,$K_3=10^{0.27}$。
目标反应=①+②+③,该反应的$\lg K = 4.29$,A错误;$c(Cu^+)=c\{[CuL]^+\}$时,两者分布分数均为0.48,则$c\{[CuL_2]^+\}\approx0.04×1×10^{-3} mol/L=4×10^{-5} mol/L$,B错误;$K_1>K_2>K_3$,n越大,$[CuL_n]^+$结合L的能力越弱,C正确;②+③得$[CuL]^+ + 2L \rightleftharpoons [CuL_3]^+$,$K=10^{1.66}$,当$c\{[CuL]^+\}=c\{[CuL_3]^+\}$时,$c(L)=10^{-0.83} mol/L$,$K_3=\frac{c\{[CuL_3]^+\}}{c\{[CuL_2]^+\}× c(L)}=10^{0.27}$,$c\{[CuL_3]^+\}=c\{[CuL_2]^+\}×10^{-0.56}\approx0.3c\{[CuL_2]^+\}$,$2c\{[CuL_2]^+\}>c\{[CuL]^+\}+3c\{[CuL_3]^+\}$,D错误。
4. (2025·河南卷,3分)乙二胺(${H_{2}NCH_{2}CH_{2}NH_{2}}$,简写为Y)可结合${H^{+}}$转化为${[H_{2}NCH_{2}CH_{2}NH_{3}]^{+}}$(简写为${HY^{+}}$)和${[H_{3}NCH_{2}CH_{2}NH_{3}]^{2+}}$(简写为${H_{2}Y^{2+}}$)。${Ag^{+}}$与Y可形成${[AgY]^{+}}$和${[AgY_{2}]^{+}}$两种配离子。室温下向${AgNO_{3}}$溶液中加入Y,通过调节混合溶液的pH改变Y的浓度,从而调控不同配离子的浓度(忽略体积变化)。混合溶液中${Ag^{+}}$和Y的初始浓度分别为$1.00× 10^{-3}\ mol/L$和$1.15× 10^{-2}\ mol/L$。$-\lg [c(M)/(mol/L)]$与$-\lg [c(Y)/(mol/L)]$的变化关系如图1所示(其中M代表${Ag^{+}}$、${[AgY]^{+}}$或${[AgY_{2}]^{+}}$),分布系数$\delta(N)$与pH的变化关系如图2所示(其中N代表Y、${HY^{+}}$或${H_{2}Y^{2+}}$)。比如$\delta({H_{2}Y^{2+}})=\dfrac{c({H_{2}Y^{2+}})}{c(Y)+c({HY^{+}})+c({H_{2}Y^{2+}})}$。
下列说法错误的是 (
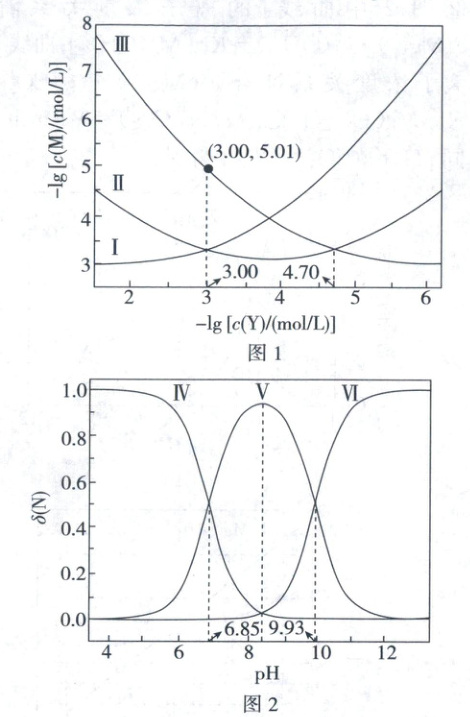
A.曲线Ⅰ对应的离子是${[AgY_{2}]^{+}}$
B.$\delta({HY^{+}})$最大时对应的${pH=8.39}$
C.反应${Ag^{+} + Y⇌ [AgY]^{+}}$的平衡常数$K_{1}=10^{4.70}$
D.$-\lg [c(Y)/(mol/L)]=3.00$时,$c({HY^{+}})>c({H_{2}Y^{2+}})>c(Y)$
下列说法错误的是 (
D
)
A.曲线Ⅰ对应的离子是${[AgY_{2}]^{+}}$
B.$\delta({HY^{+}})$最大时对应的${pH=8.39}$
C.反应${Ag^{+} + Y⇌ [AgY]^{+}}$的平衡常数$K_{1}=10^{4.70}$
D.$-\lg [c(Y)/(mol/L)]=3.00$时,$c({HY^{+}})>c({H_{2}Y^{2+}})>c(Y)$
答案:
4.D 离子图像综合分析
【图像分析】乙二胺(Y)浓度越大,生成$[AgY_2]^+$的量就越多;pH越小,$H_2Y^{2+}$的浓度越大。曲线Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ分别代表:$[AgY_2]^+$、$[AgY]^+$、$Ag^+$、$H_2Y^{2+}$、$HY^+$、Y。
由图像分析可知,A正确;由图2可知,pH=6.85时,$c(H_2Y^{2+})=c(HY^+)$,对于$H_2Y^{2+}$的电离平衡来说,$K_1=\frac{c(HY^+)· c(H^+)}{c(H_2Y^{2+})}=10^{-6.85}$,pH=9.93时,$c(HY^+)=c(Y)$,$K_2=\frac{c(Y)· c(H^+)}{c(HY^+)}=10^{-9.93}$,$\delta(HY^+)$最大时$c(H_2Y^{2+})=c(Y)$,此时$K_1K_2=\frac{c^2(H^+)· c(Y)}{c(H_2Y^{2+})}=10^{-6.85}×10^{-9.93}$,即pH=8.39,B正确;当Y浓度为$10^{-4.70} mol/L$时,$Ag^+$和$[AgY]^+$浓度相等,代入平衡常数表达式求得平衡常数为$10^{4.70}$,C正确;由图1可知,当$-\lg[c(Y)/(mol/L)]=3.00$时$c(Ag^+)=10^{-5.01} mol/L$,即Y浓度为$0.0010 mol/L$时,$Ag^+$近似完全反应,转化为等浓度的$[AgY_2]^+$和$[AgY]^+$,消耗Y $0.0015 mol/L$,剩余含Y粒子总量为$0.010 mol/L$,其中Y的浓度为$0.0010 mol/L$,占总量的10%,观察图2可知浓度大小顺序是$HY^+>Y>H_2Y^{2+}$,D错误。
【图像分析】乙二胺(Y)浓度越大,生成$[AgY_2]^+$的量就越多;pH越小,$H_2Y^{2+}$的浓度越大。曲线Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ分别代表:$[AgY_2]^+$、$[AgY]^+$、$Ag^+$、$H_2Y^{2+}$、$HY^+$、Y。
由图像分析可知,A正确;由图2可知,pH=6.85时,$c(H_2Y^{2+})=c(HY^+)$,对于$H_2Y^{2+}$的电离平衡来说,$K_1=\frac{c(HY^+)· c(H^+)}{c(H_2Y^{2+})}=10^{-6.85}$,pH=9.93时,$c(HY^+)=c(Y)$,$K_2=\frac{c(Y)· c(H^+)}{c(HY^+)}=10^{-9.93}$,$\delta(HY^+)$最大时$c(H_2Y^{2+})=c(Y)$,此时$K_1K_2=\frac{c^2(H^+)· c(Y)}{c(H_2Y^{2+})}=10^{-6.85}×10^{-9.93}$,即pH=8.39,B正确;当Y浓度为$10^{-4.70} mol/L$时,$Ag^+$和$[AgY]^+$浓度相等,代入平衡常数表达式求得平衡常数为$10^{4.70}$,C正确;由图1可知,当$-\lg[c(Y)/(mol/L)]=3.00$时$c(Ag^+)=10^{-5.01} mol/L$,即Y浓度为$0.0010 mol/L$时,$Ag^+$近似完全反应,转化为等浓度的$[AgY_2]^+$和$[AgY]^+$,消耗Y $0.0015 mol/L$,剩余含Y粒子总量为$0.010 mol/L$,其中Y的浓度为$0.0010 mol/L$,占总量的10%,观察图2可知浓度大小顺序是$HY^+>Y>H_2Y^{2+}$,D错误。
查看更多完整答案,请扫码查看


