2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第90页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
2. (2025·广东卷,14分)钛单质及其化合物在航空、航天、催化等领域应用广泛。
(1)基态${Ti}$原子的价层电子排布式为_______ 。
(2)298 K下,反应${TiO_{2}(s) + 2C(s) + 2Cl_{2}(g)\xlongequal{}TiCl_{4}(g) + 2CO(g)}$的$\Delta H<0$、$\Delta S>0$,则298 K下该反应_______ (填“能”或“不能”)自发进行。
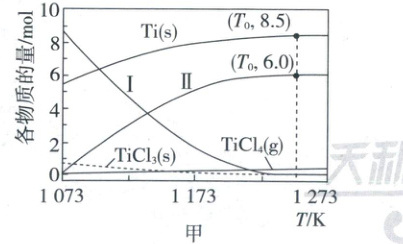
(3)以${TiCl_{4}}$为原料可制备${TiCl_{3}}$。将5.0 mol ${TiCl_{4}}$与10.0 mol ${Ti}$放入容积为$V_{0}\ {L}$的恒容密闭容器中,反应体系存在下列过程。
①$\Delta H_{1}=$_______ ${kJ/mol}$。
②不同温度下,平衡时反应体系的组成如图甲。曲线Ⅰ对应的物质为_______ 。
③温度$T_{0}\ {K}$下,$n\left \lbrack {TiCl_{4}(g)}\right \rbrack =$_______ ${mol}$,反应(c)的平衡常数$K=$_______ (列出算式,无须化简)。
(4)钛基催化剂可以催化储氢物质肼(${N_{2}H_{4}}$)的分解反应:
(e)${N_{2}H_{4}\xlongequal{}N_{2} + 2H_{2}}$
(f)${3N_{2}H_{4}\xlongequal{}N_{2} + 4NH_{3}}$
为研究某钛基催化剂对上述反应的影响,以肼的水溶液为原料(含${N_{2}H_{4}}$的物质的量为$n_{0}$),进行实验,得到$\dfrac{n_{1}}{n_{0}}$、$\dfrac{n_{2}}{n_{0}}$随时间$t$变化的曲线如图乙。其中,$n_{1}$为${H_{2}}$与${N_{2}}$的物质的量之和;$n_{2}$为剩余${N_{2}H_{4}}$的物质的量。设$n_{e}$为$0~t$时间段内反应(e)消耗${N_{2}H_{4}}$的物质的量,该时间段内,本体系中催化剂的选择性用$\dfrac{n_{e}}{n_{0}-n_{2}}× 100\%$表示。
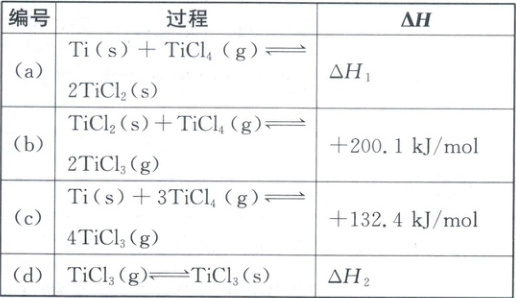
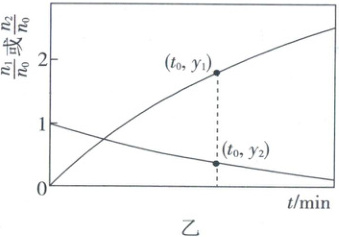
①$0~t_{0}\ {min}$内,${N_{2}H_{4}}$的转化率为_______ (用含$y_{2}$的代数式表示)。
②$0~t_{0}\ {min}$内,催化剂的选择性为_______ (用含$y_{1}$与$y_{2}$的代数式表示,写出推导过程)。
(1)基态${Ti}$原子的价层电子排布式为_______ 。
(2)298 K下,反应${TiO_{2}(s) + 2C(s) + 2Cl_{2}(g)\xlongequal{}TiCl_{4}(g) + 2CO(g)}$的$\Delta H<0$、$\Delta S>0$,则298 K下该反应_______ (填“能”或“不能”)自发进行。
(3)以${TiCl_{4}}$为原料可制备${TiCl_{3}}$。将5.0 mol ${TiCl_{4}}$与10.0 mol ${Ti}$放入容积为$V_{0}\ {L}$的恒容密闭容器中,反应体系存在下列过程。
①$\Delta H_{1}=$_______ ${kJ/mol}$。
②不同温度下,平衡时反应体系的组成如图甲。曲线Ⅰ对应的物质为_______ 。
③温度$T_{0}\ {K}$下,$n\left \lbrack {TiCl_{4}(g)}\right \rbrack =$_______ ${mol}$,反应(c)的平衡常数$K=$_______ (列出算式,无须化简)。
(4)钛基催化剂可以催化储氢物质肼(${N_{2}H_{4}}$)的分解反应:
(e)${N_{2}H_{4}\xlongequal{}N_{2} + 2H_{2}}$
(f)${3N_{2}H_{4}\xlongequal{}N_{2} + 4NH_{3}}$
为研究某钛基催化剂对上述反应的影响,以肼的水溶液为原料(含${N_{2}H_{4}}$的物质的量为$n_{0}$),进行实验,得到$\dfrac{n_{1}}{n_{0}}$、$\dfrac{n_{2}}{n_{0}}$随时间$t$变化的曲线如图乙。其中,$n_{1}$为${H_{2}}$与${N_{2}}$的物质的量之和;$n_{2}$为剩余${N_{2}H_{4}}$的物质的量。设$n_{e}$为$0~t$时间段内反应(e)消耗${N_{2}H_{4}}$的物质的量,该时间段内,本体系中催化剂的选择性用$\dfrac{n_{e}}{n_{0}-n_{2}}× 100\%$表示。


①$0~t_{0}\ {min}$内,${N_{2}H_{4}}$的转化率为_______ (用含$y_{2}$的代数式表示)。
②$0~t_{0}\ {min}$内,催化剂的选择性为_______ (用含$y_{1}$与$y_{2}$的代数式表示,写出推导过程)。

答案:
2.(14分)
(1)3d⁴4s²
(2)能
(3)① - 267.8 ②$TiCl_3(s)$ ③0.5
(4)①$(1 - y_2)×100\%$ ②设$t_0$min时,反应(e)转化$a$mol $N_2H_4$,反应(f)转化$3b$mol $N_2H_4$,据此列出三段式:
$N_2H_4 \rightleftharpoons N_2 + 2H_2$
转化(mol) $a$ $a$ $2a$
$3N_2H_4 \rightleftharpoons N_2 + 4NH_3$
转化(mol) $3b$ $b$ $4b$
则$n_1 = 3a + b$ $n_2 = n_0 - (a + 3b)$
$\frac{3a + b}{n_0}=y_1$……① $\frac{n_0 - (a + 3b)}{n_0}=y_2$……②
联立①②可得:$a = \frac{3y_1 + y_2 - 1}{8}n_0$,$b = \frac{3 - y_1 - 3y_2}{8}n_0$
则$0 - t_0$min时,催化剂的选择性为$\frac{\frac{3y_1 + y_2 - 1}{8}n_0}{(1 - y_2)n_0}×100\%=\frac{3y_1 + y_2 - 1}{8(1 - y_2)}×100\%$
[解析]化学反应原理综合
(1)Ti原子序数为22,价层电子排布式为$3d⁴4s²$。
(2)$\Delta H - T×\Delta S < 0$时反应可以自发进行,结合该反应的$\Delta H < 0$、$\Delta S > 0$,该反应在任何温度下均能自发进行。
(3)①根据盖斯定律,反应(a)=反应(c)-2×反应(b),$\Delta H_1 = +132.4$kJ/mol - 2×200.1kJ/mol = - 267.8kJ/mol;②升高温度反应(a)平衡逆向移动,反应(b)和反应(c)平衡正向移动,$TiCl_2(s)$减少,$TiCl_3(g)$增多,两者分别对应曲线I和Ⅱ;③利用Ti元素守恒进行计算,反应前钛元素共15.0mol,温度$T_0$K下$n[Ti(s)] = 8.5$mol,$n[TiCl_3(g)] = 6.0$mol,$n[TiCl_2(s)] = n[TiCl_4(s)] = 0$mol,则$n[TiCl_4(g)] = 0.5$mol,反应(c)的平衡常数$K = \frac{(\frac{6}{V_0})^4}{(\frac{0.5}{V_0})^3}$。
(4)①$y_1$对应曲线起始点纵坐标为0,表示$\frac{n_1}{n_0}$,$y_2$对应曲线起始点纵坐标为1,表示$\frac{n_2}{n_0}$,$0 - t_0$min内$N_2H_4$的转化率为$\frac{n_0 - n_2}{n_0}$,即$(1 - y_2)×100\%$。
(1)3d⁴4s²
(2)能
(3)① - 267.8 ②$TiCl_3(s)$ ③0.5
(4)①$(1 - y_2)×100\%$ ②设$t_0$min时,反应(e)转化$a$mol $N_2H_4$,反应(f)转化$3b$mol $N_2H_4$,据此列出三段式:
$N_2H_4 \rightleftharpoons N_2 + 2H_2$
转化(mol) $a$ $a$ $2a$
$3N_2H_4 \rightleftharpoons N_2 + 4NH_3$
转化(mol) $3b$ $b$ $4b$
则$n_1 = 3a + b$ $n_2 = n_0 - (a + 3b)$
$\frac{3a + b}{n_0}=y_1$……① $\frac{n_0 - (a + 3b)}{n_0}=y_2$……②
联立①②可得:$a = \frac{3y_1 + y_2 - 1}{8}n_0$,$b = \frac{3 - y_1 - 3y_2}{8}n_0$
则$0 - t_0$min时,催化剂的选择性为$\frac{\frac{3y_1 + y_2 - 1}{8}n_0}{(1 - y_2)n_0}×100\%=\frac{3y_1 + y_2 - 1}{8(1 - y_2)}×100\%$
[解析]化学反应原理综合
(1)Ti原子序数为22,价层电子排布式为$3d⁴4s²$。
(2)$\Delta H - T×\Delta S < 0$时反应可以自发进行,结合该反应的$\Delta H < 0$、$\Delta S > 0$,该反应在任何温度下均能自发进行。
(3)①根据盖斯定律,反应(a)=反应(c)-2×反应(b),$\Delta H_1 = +132.4$kJ/mol - 2×200.1kJ/mol = - 267.8kJ/mol;②升高温度反应(a)平衡逆向移动,反应(b)和反应(c)平衡正向移动,$TiCl_2(s)$减少,$TiCl_3(g)$增多,两者分别对应曲线I和Ⅱ;③利用Ti元素守恒进行计算,反应前钛元素共15.0mol,温度$T_0$K下$n[Ti(s)] = 8.5$mol,$n[TiCl_3(g)] = 6.0$mol,$n[TiCl_2(s)] = n[TiCl_4(s)] = 0$mol,则$n[TiCl_4(g)] = 0.5$mol,反应(c)的平衡常数$K = \frac{(\frac{6}{V_0})^4}{(\frac{0.5}{V_0})^3}$。
(4)①$y_1$对应曲线起始点纵坐标为0,表示$\frac{n_1}{n_0}$,$y_2$对应曲线起始点纵坐标为1,表示$\frac{n_2}{n_0}$,$0 - t_0$min内$N_2H_4$的转化率为$\frac{n_0 - n_2}{n_0}$,即$(1 - y_2)×100\%$。
3. (2024·贵州卷,14分)在无氧环境下,${CH_{4}}$经催化脱氢芳构化可以直接转化为高附加值的芳烃产品。一定温度下,${CH_{4}}$芳构化时同时存在如下反应:
ⅰ.${CH_{4}(g)\longrightarrow C(s) + 2H_{2}(g)}\ \ \Delta H_{1}=+74.6\ {kJ/mol}\ \ \Delta S=+80.84\ {J/(mol· K)}$
ⅱ.${6CH_{4}(g)\longrightarrow C_{6}H_{6}(l) + 9H_{2}(g)}\ \ \Delta H_{2}$
回答下列问题:
(1)反应ⅰ在1 000 K时
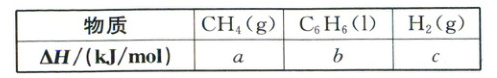
(2)已知$25\ ^{\circ}C$时有关物质的燃烧热数据如表,则反应ⅱ的$\Delta H_{2}=$
(3)受反应ⅰ影响,随着反应进行,单位时间内甲烷转化率和芳烃产率逐渐降低,原因是
(4)对催化剂在不同的${pH}$条件下进行处理,能够改变催化剂的活性。将催化剂在5种不同${pH}$条件下处理后分别用于催化${CH_{4}}$芳构化,相同反应时间内测定相关数据如表,其中最佳${pH}$为
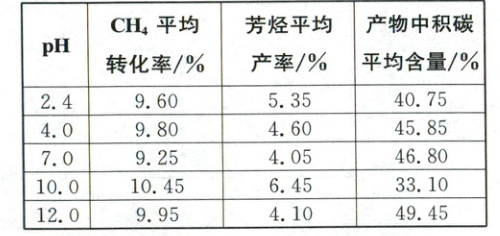
(5)973 K、100 kPa下,在某密闭容器中按$n({C_{6}H_{6}}):n({CH_{4}})=1:5$充入气体,发生反应${C_{6}H_{6}(g) + CH_{4}(g)\longrightarrow C_{7}H_{8}(g) + H_{2}(g)}$,平衡时${C_{6}H_{6}}$与${C_{7}H_{8}}$的分压比为$4:1$,则${C_{6}H_{6}}$的平衡转化率为
(6)引入丙烷可促进甲烷芳构化制备苯和二甲苯,反应如下:
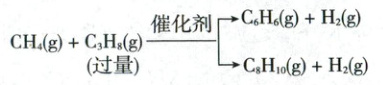
${CH_{4}(g) + \underset{(过量)}{{C_{3}H_{8}(g)}}\xlongequal{催化剂}\begin{cases}{C_{6}H_{6}(g) + H_{2}(g)}\\{C_{8}H_{10}(g) + H_{2}(g)}\end{cases}}$
(两个反应可视为同级数的平行反应)
对于同级数的平行反应有$\dfrac{v_{1}}{v_{2}}=\dfrac{k_{1}}{k_{2}}=\dfrac{A_{1}}{A_{2}}e^{\frac{E_{a,2}-E_{a,1}}{RT}}$,其中$v$、$k$分别为反应速率和反应速率常数,$E_{a}$为反应活化能,$A_{1}$、$A_{2}$为定值,$R$为常数,$T$为温度,同一温度下$\dfrac{k_{1}}{k_{2}}$是定值。已知$E_{a,苯}< E_{a,二甲苯}$,若要提高苯的产率,可采取的措施有
ⅰ.${CH_{4}(g)\longrightarrow C(s) + 2H_{2}(g)}\ \ \Delta H_{1}=+74.6\ {kJ/mol}\ \ \Delta S=+80.84\ {J/(mol· K)}$
ⅱ.${6CH_{4}(g)\longrightarrow C_{6}H_{6}(l) + 9H_{2}(g)}\ \ \Delta H_{2}$
回答下列问题:
(1)反应ⅰ在1 000 K时
能
(填“能”或“不能”)自发进行。(2)已知$25\ ^{\circ}C$时有关物质的燃烧热数据如表,则反应ⅱ的$\Delta H_{2}=$
6a - b - 9c
${kJ/mol}$(用含$a$、$b$、$c$的代数式表示)。
(3)受反应ⅰ影响,随着反应进行,单位时间内甲烷转化率和芳烃产率逐渐降低,原因是
反应i产生的C(s)附着在催化剂表面,使CH₄与催化剂的接触面积减小,反应速率减慢
。(4)对催化剂在不同的${pH}$条件下进行处理,能够改变催化剂的活性。将催化剂在5种不同${pH}$条件下处理后分别用于催化${CH_{4}}$芳构化,相同反应时间内测定相关数据如表,其中最佳${pH}$为
10.0
,理由是CH₄平均转化率最大,芳烃平均产率最高,产物中积碳平均含量最低
。
(5)973 K、100 kPa下,在某密闭容器中按$n({C_{6}H_{6}}):n({CH_{4}})=1:5$充入气体,发生反应${C_{6}H_{6}(g) + CH_{4}(g)\longrightarrow C_{7}H_{8}(g) + H_{2}(g)}$,平衡时${C_{6}H_{6}}$与${C_{7}H_{8}}$的分压比为$4:1$,则${C_{6}H_{6}}$的平衡转化率为
20%
,平衡常数$K_{p}=$$\frac{(\frac{0.2^2}{6} × 100 kPa)^2}{0.8 × 4.8}$或$\frac{(\frac{0.8}{6} × 100 kPa) × (\frac{4.8}{6} × 100 kPa)}{}$
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,列出计算式即可)。(6)引入丙烷可促进甲烷芳构化制备苯和二甲苯,反应如下:

${CH_{4}(g) + \underset{(过量)}{{C_{3}H_{8}(g)}}\xlongequal{催化剂}\begin{cases}{C_{6}H_{6}(g) + H_{2}(g)}\\{C_{8}H_{10}(g) + H_{2}(g)}\end{cases}}$
(两个反应可视为同级数的平行反应)
对于同级数的平行反应有$\dfrac{v_{1}}{v_{2}}=\dfrac{k_{1}}{k_{2}}=\dfrac{A_{1}}{A_{2}}e^{\frac{E_{a,2}-E_{a,1}}{RT}}$,其中$v$、$k$分别为反应速率和反应速率常数,$E_{a}$为反应活化能,$A_{1}$、$A_{2}$为定值,$R$为常数,$T$为温度,同一温度下$\dfrac{k_{1}}{k_{2}}$是定值。已知$E_{a,苯}< E_{a,二甲苯}$,若要提高苯的产率,可采取的措施有
加入选择性更高的催化剂(或适当降低温度)
。
答案:
3.(14分)
(1)能
(2)6a - b - 9c
(3)反应i产生的C(s)附着在催化剂表面,使CH₄与催化剂的接触面积减小,反应速率减慢
(4)10.0 $CH_4$平均转化率最大,芳烃平均产率最高,产物中积碳平均含量最低
(5)20% $\frac{(\frac{0.2^2}{6} × 100 kPa)^2}{0.8 × 4.8}$或$\frac{(\frac{0.8}{6} × 100 kPa) × (\frac{4.8}{6} × 100 kPa)}{}$
(6)加入选择性更高的催化剂(或适当降低温度)
[解析]化学反应原理
(1)1000K时,$\Delta G = \Delta H - T\Delta S = 74.6$kJ/mol - 1000K×80.84×10⁻³kJ/(mol·K) < 0,该反应能自发进行。
(2)由表中各物质的燃烧热数据可知,①$CH_4(g)+2O_2(g)\rightleftharpoons CO_2(g)+2H_2O(l)$ $\Delta H = a$kJ/mol;②$C_6H_6(l)+\frac{15}{2}O_2(g)\rightleftharpoons 6CO_2(g)+3H_2O(l)$ $\Delta H = b$kJ/mol;③$H_2(g)+\frac{1}{2}O_2(g)\rightleftharpoons H_2O(l)$ $\Delta H = c$kJ/mol;根据盖斯定律,$\Delta H_2 = 6×① - ② - 9×③ = (6a - b - 9c)$kJ/mol。
(4)从$CH_4$平均转化率(尽可能高)、芳烃平均产率(尽可能高)、产物中积碳平均含量(尽可能低)角度综合考虑,最佳pH为10.0。
(5)该反应是气体分子数不变的反应,设起始时$c(C_6H_6)$、$c(CH_4)$分别是1mol/L、5mol/L,平衡时$C_6H_6$与$C_6H_8$的分压比为4:1,即二者平衡浓度比为4:1,设$C_6H_6$转化的物质的量浓度为$x$,列三段式:
$C_6H_6(g)+CH_4(g)\rightleftharpoons C_6H_8(g)+H_2(g)$
$c_始/(mol/L)$ 1 5
$\Delta c/(mol/L)$ $x$ $x$ $x$ $x$
$c_平衡/(mol/L)$ 1 - $x$ 5 - $x$ $x$ $x$
则$\frac{1 - x}{x} = 4$,$x = 0.2$,$C_6H_6$的平衡转化率为$\frac{0.2mol/L}{1mol/L}×100\% = 20\%$,平衡常数$K_p = \frac{0.2^2}{0.8×4.8}$。
(6)生成苯的反应和生成二甲苯的反应为平行反应(竞争反应),若要提高苯的产率,可通过调节两个反应的速率来实现,如加入选择性合适的催化剂,或者适当降低温度,低温下活化能小的反应相对速率更快。
易错警示:
(3)问的是单位时间内甲烷转化率和芳烃产率逐渐降低的原因,由于是“单位时间内”,应从化学反应速率角度考虑而不是平衡转化率。
(1)能
(2)6a - b - 9c
(3)反应i产生的C(s)附着在催化剂表面,使CH₄与催化剂的接触面积减小,反应速率减慢
(4)10.0 $CH_4$平均转化率最大,芳烃平均产率最高,产物中积碳平均含量最低
(5)20% $\frac{(\frac{0.2^2}{6} × 100 kPa)^2}{0.8 × 4.8}$或$\frac{(\frac{0.8}{6} × 100 kPa) × (\frac{4.8}{6} × 100 kPa)}{}$
(6)加入选择性更高的催化剂(或适当降低温度)
[解析]化学反应原理
(1)1000K时,$\Delta G = \Delta H - T\Delta S = 74.6$kJ/mol - 1000K×80.84×10⁻³kJ/(mol·K) < 0,该反应能自发进行。
(2)由表中各物质的燃烧热数据可知,①$CH_4(g)+2O_2(g)\rightleftharpoons CO_2(g)+2H_2O(l)$ $\Delta H = a$kJ/mol;②$C_6H_6(l)+\frac{15}{2}O_2(g)\rightleftharpoons 6CO_2(g)+3H_2O(l)$ $\Delta H = b$kJ/mol;③$H_2(g)+\frac{1}{2}O_2(g)\rightleftharpoons H_2O(l)$ $\Delta H = c$kJ/mol;根据盖斯定律,$\Delta H_2 = 6×① - ② - 9×③ = (6a - b - 9c)$kJ/mol。
(4)从$CH_4$平均转化率(尽可能高)、芳烃平均产率(尽可能高)、产物中积碳平均含量(尽可能低)角度综合考虑,最佳pH为10.0。
(5)该反应是气体分子数不变的反应,设起始时$c(C_6H_6)$、$c(CH_4)$分别是1mol/L、5mol/L,平衡时$C_6H_6$与$C_6H_8$的分压比为4:1,即二者平衡浓度比为4:1,设$C_6H_6$转化的物质的量浓度为$x$,列三段式:
$C_6H_6(g)+CH_4(g)\rightleftharpoons C_6H_8(g)+H_2(g)$
$c_始/(mol/L)$ 1 5
$\Delta c/(mol/L)$ $x$ $x$ $x$ $x$
$c_平衡/(mol/L)$ 1 - $x$ 5 - $x$ $x$ $x$
则$\frac{1 - x}{x} = 4$,$x = 0.2$,$C_6H_6$的平衡转化率为$\frac{0.2mol/L}{1mol/L}×100\% = 20\%$,平衡常数$K_p = \frac{0.2^2}{0.8×4.8}$。
(6)生成苯的反应和生成二甲苯的反应为平行反应(竞争反应),若要提高苯的产率,可通过调节两个反应的速率来实现,如加入选择性合适的催化剂,或者适当降低温度,低温下活化能小的反应相对速率更快。
易错警示:
(3)问的是单位时间内甲烷转化率和芳烃产率逐渐降低的原因,由于是“单位时间内”,应从化学反应速率角度考虑而不是平衡转化率。
查看更多完整答案,请扫码查看


