2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第14页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
7. 【学术探索】(2024·江西卷,3分)我国学者把游离态氮固定在碳上(示踪反应如下),制得的$ {[N\xlongequal{}C\xlongequal{}N]^{2-}} $离子可用于合成核酸的结构单元。阿伏加德罗常数的值为$ N_{A} $,下列说法正确的是 (
$ {^{15}N_{2} + C(石墨) + 2LiH\xlongequal[5\ h]{20\ atm,550\ ^{\circ}C}Li_{2}[^{15}NC^{15}N] + H_{2}} $
A.22.4 L $ {^{15}N_{2}} $含有的中子数为$ 16N_{A} $
B.12 g $ {C(石墨)} $中$ sp^{2} $杂化轨道含有的电子数为$ 6N_{A} $
C.1 mol $ {[N\xlongequal{}C\xlongequal{}N]^{2-}} $中含有的$ \pi $键数为$ 4N_{A} $
D.生成1 mol $ {H_{2}} $时,总反应转移的电子数为$ 6N_{A} $
D
)$ {^{15}N_{2} + C(石墨) + 2LiH\xlongequal[5\ h]{20\ atm,550\ ^{\circ}C}Li_{2}[^{15}NC^{15}N] + H_{2}} $
A.22.4 L $ {^{15}N_{2}} $含有的中子数为$ 16N_{A} $
B.12 g $ {C(石墨)} $中$ sp^{2} $杂化轨道含有的电子数为$ 6N_{A} $
C.1 mol $ {[N\xlongequal{}C\xlongequal{}N]^{2-}} $中含有的$ \pi $键数为$ 4N_{A} $
D.生成1 mol $ {H_{2}} $时,总反应转移的电子数为$ 6N_{A} $
答案:
7.D 阿伏加德罗常数的相关计算 没有明确是标准状况下的体积,无法计算,A错误;石墨中每个碳原子的$3$个$sp^2$杂化轨道中各有$1$个电子,成键以后杂化轨道中总电子数不变,$12\ g$石墨中碳原子数为$N_A$,因此$sp^2$杂化轨道含有的电子数为$3N_A$,B错误;$1\ \text{mol [N≡C—N]^{2-}}$中含有$\pi$键的数目为$2N_A$,C错误;生成$1$个$H_2$,该反应转移$6$个电子,因此生成$1\ mol$氢气时总反应转移电子数为$6N_A$,D正确。
8. (2023·广东卷,2分)设$ N_{A} $为阿伏加德罗常数的值。侯氏制碱法涉及$ {NaCl} $、$ {NH_{4}Cl} $和$ {NaHCO_{3}} $等物质。
下列叙述正确的是 (
A.1 mol $ {NH_{4}Cl} $含有的共价键数目为$ 5N_{A} $
B.1 mol $ {NaHCO_{3}} $完全分解,得到的$ {CO_{2}} $分子数目为$ 2N_{A} $
C.体积为1 L的1 mol/L $ {NaHCO_{3}} $溶液中,$ {HCO^{-}_{3}} $数目为$ N_{A} $
D.$ {NaCl} $和$ {NH_{4}Cl} $的混合物中含1 mol $ {Cl^{-}} $,则混合物中质子数为$ 28N_{A} $
下列叙述正确的是 (
D
)A.1 mol $ {NH_{4}Cl} $含有的共价键数目为$ 5N_{A} $
B.1 mol $ {NaHCO_{3}} $完全分解,得到的$ {CO_{2}} $分子数目为$ 2N_{A} $
C.体积为1 L的1 mol/L $ {NaHCO_{3}} $溶液中,$ {HCO^{-}_{3}} $数目为$ N_{A} $
D.$ {NaCl} $和$ {NH_{4}Cl} $的混合物中含1 mol $ {Cl^{-}} $,则混合物中质子数为$ 28N_{A} $
答案:
8.D 阿伏加德罗常数 $1\ mol NH_4Cl$中含有的共价键数目为$4N_A$,A错误;$1\ mol NaHCO_3$完全分解,得到的$CO_2$分子数目为$0.5N_A$,B错误;$HCO_3^-$在水溶液中能发生电离和水解,体积为$1\ L$的$1\ mol/L NaHCO_3$溶液中,$HCO_3^-$数目小于$N_A$,C错误;$NaCl$和$NH_4Cl$中均含有$28$个质子,$NaCl$和$NH_4Cl$的混合物中含$1\ mol Cl^-$,则混合物的总物质的量为$1\ mol$,则混合物中质子数为$28N_A$,D正确。
9. (2023·辽宁卷,3分)我国古代四大发明之一黑火药的爆炸反应为:$ {S + 2KNO_{3} + 3C\xlongequal{}K_{2}S + N_{2}\uparrow + 3CO_{2}\uparrow} $。设$ N_{A} $为阿伏加德罗常数的值,下列说法正确的是 (
A.11.2 L $ {CO_{2}} $含$ \pi $键数目为$ N_{A} $
B.每生成2.8 g $ {N_{2}} $转移电子数目为$ N_{A} $
C.0.1 mol $ {KNO_{3}} $晶体中含离子数目为$ 0.2N_{A} $
D.1 L 0.1 mol/L $ {K_{2}S} $溶液中含$ {S^{2-}} $数目为$ 0.1N_{A} $
C
)A.11.2 L $ {CO_{2}} $含$ \pi $键数目为$ N_{A} $
B.每生成2.8 g $ {N_{2}} $转移电子数目为$ N_{A} $
C.0.1 mol $ {KNO_{3}} $晶体中含离子数目为$ 0.2N_{A} $
D.1 L 0.1 mol/L $ {K_{2}S} $溶液中含$ {S^{2-}} $数目为$ 0.1N_{A} $
答案:
9.C 阿伏加德罗常数 未指明为标准状况,无法计算$11.2\ L CO_2$的物质的量,A错误;反应前后,$S$元素的化合价由$0$降低为$-2$,$N$元素的化合价由$+5$降低为$0$,$C$元素的化合价由$0$升高为$+4$,则每生成$1$个$N_2$分子,转移$12$个电子,则每生成$2.8\ g N_2$转移的电子数目为$1.2N_A$,B错误;$KNO_3$晶体由$K^+$和$NO_3^-$构成,$0.1\ mol KNO_3$晶体中含离子数目为$0.2N_A$,C正确;$S^{2-}$在水溶液中会发生水解,$1\ L\ 0.1\ mol/L K_2S$溶液中含$S^{2-}$数目小于$0.1N_A$,D错误。
10. (2022·辽宁卷,3分)设$ N_{A} $为阿伏加德罗常数的值。下列说法正确的是 (
A.1.8 g $ {^{18}O} $中含有的中子数为$ N_{A} $
B.28 g $ {C_{2}H_{4}} $分子中含有的$ \sigma $键数目为$ 4N_{A} $
C.标准状况下,22.4 L $ {HCl} $气体中$ {H^{+}} $数目为$ N_{A} $
D.$ pH=12 $的$ {Na_{2}CO_{3}} $溶液中$ {OH^{-}} $数目为$ 0.01N_{A} $
A
)A.1.8 g $ {^{18}O} $中含有的中子数为$ N_{A} $
B.28 g $ {C_{2}H_{4}} $分子中含有的$ \sigma $键数目为$ 4N_{A} $
C.标准状况下,22.4 L $ {HCl} $气体中$ {H^{+}} $数目为$ N_{A} $
D.$ pH=12 $的$ {Na_{2}CO_{3}} $溶液中$ {OH^{-}} $数目为$ 0.01N_{A} $
答案:
10.A 阿伏加德罗常数 $^{18}O$的中子数为$10$,$1.8\ g\ ^{18}O$的物质的量为$0.1\ mol$,则所含的中子数为$N_A$,A正确;$1$个乙烯分子中含有$5$个$\sigma$键,$28\ g$乙烯的物质的量为$1\ mol$,所含$\sigma$键数目为$5N_A$,B错误;氯化氢为共价化合物,不含有氢离子,C错误;没有指明所给碳酸钠溶液的温度和体积,无法计算溶液中的氢氧根离子的数目,D错误。
1. (2023·全国甲卷,6分)实验室将粗盐提纯并配制$ 0.1000\ mol/L $的$ NaCl $溶液。下列仪器中,本实验必须用到的有(
①天平 ②温度计 ③坩埚 ④分液漏斗
⑤容量瓶 ⑥烧杯 ⑦滴定管 ⑧酒精灯
A.①②④⑥
B.①④⑤⑥
C.②③⑦⑧
D.①⑤⑥⑧
D
)①天平 ②温度计 ③坩埚 ④分液漏斗
⑤容量瓶 ⑥烧杯 ⑦滴定管 ⑧酒精灯
A.①②④⑥
B.①④⑤⑥
C.②③⑦⑧
D.①⑤⑥⑧
答案:
1.D 实验仪器的选择 实验室粗盐提纯过程中,需将杂质离 子转化成沉淀再通过“过滤”操作将它们除去,此时需要烧杯、漏斗和玻璃棒,再向滤液中加入过量稀盐酸转化成NaCl和HCl的混合液,最后通过“蒸发结晶”操作获得精盐,该操作中需使用酒精灯、蒸发皿、玻璃棒。将提纯后的精盐按照计算、称量、溶解、转移、洗涤、定容、摇匀等操作,配制成所需溶液,需要天平、容量瓶、烧杯、玻璃棒、胶头滴管等仪器。故完成本次实验需要①天平、⑤容量瓶、⑥烧杯、⑧酒精灯,故选D。
2. (2022·广东卷,节选,2分)食醋是烹饪美食的调味品,有效成分主要为醋酸(用$ HAc $表示)。$ HAc $的应用与其电离平衡密切相关。$ 25\ °C $时,
$ HAc $的$ K_{a} = 1.75 × 10^{-5} = 10^{-4.76} $。
(1) 配制$ 250\ mL\ 0.1\ mol/L $的$ HAc $溶液,需$ 5\ mol/L\ HAc $溶液的体积为
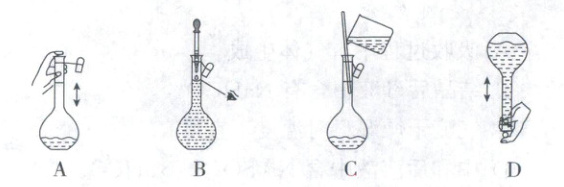
(2) 下列关于$ 250\ mL $容量瓶的操作,正确的是
$ HAc $的$ K_{a} = 1.75 × 10^{-5} = 10^{-4.76} $。
(1) 配制$ 250\ mL\ 0.1\ mol/L $的$ HAc $溶液,需$ 5\ mol/L\ HAc $溶液的体积为
5
$ mL $。(2) 下列关于$ 250\ mL $容量瓶的操作,正确的是
C
。
答案:
2.(2分)
(1)5
(2)C
【解析】溶液的配制
(1)根据稀释定律可知:250mL×0.1mol/L=V×5mol/L,V=5mL。
(2)摇匀溶液时,盖紧瓶塞,采用倒转和摇动的方法使液体混合均匀,同时一手托容量瓶底部一手握瓶颈,A、D错误;定容时视线应与凹液面最低处相切,B错误;移液时用玻璃棒引流且玻璃棒底端在容量瓶刻线以下,C正确。
(1)5
(2)C
【解析】溶液的配制
(1)根据稀释定律可知:250mL×0.1mol/L=V×5mol/L,V=5mL。
(2)摇匀溶液时,盖紧瓶塞,采用倒转和摇动的方法使液体混合均匀,同时一手托容量瓶底部一手握瓶颈,A、D错误;定容时视线应与凹液面最低处相切,B错误;移液时用玻璃棒引流且玻璃棒底端在容量瓶刻线以下,C正确。
查看更多完整答案,请扫码查看


