2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第64页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
1. (2024·广东卷,2分)我国自主设计建造的浮式生产储卸油装置“海葵一号”将在珠江口盆地海域使用,其钢铁外壳镶嵌了锌块,以利用电化学原理延缓外壳的腐蚀。下列有关说法正确的是 (
A.钢铁外壳为负极
B.镶嵌的锌块可永久使用
C.该法为外加电流法
D.锌发生反应:$ {Zn - 2e^- = Zn^{2+}} $
D
)A.钢铁外壳为负极
B.镶嵌的锌块可永久使用
C.该法为外加电流法
D.锌发生反应:$ {Zn - 2e^- = Zn^{2+}} $
答案:
1.D 电化学防腐蚀原理 钢铁外壳镶嵌锌块防腐蚀属于牺牲阳极法,钢铁外壳和锌块组成原电池,钢铁外壳作正极被保护,A、C错误;镶嵌的锌块作原电池负极,发生的电极反应为$Zn−2e−=Zn^{2+},$属于损耗电极,需要定期更换,B错误、D正确。
2. 【中国科技】(2024·湖北卷,3分)2024年5月8日,我国第三艘航空母舰福建舰顺利完成首次海试。舰体表面需要采取有效的防锈措施,下列防锈措施中不形成表面钝化膜的是 (
A.发蓝处理
B.阳极氧化
C.表面渗镀
D.喷涂油漆
D
)A.发蓝处理
B.阳极氧化
C.表面渗镀
D.喷涂油漆
答案:
2.D 金属的防护 发蓝处理可使钢铁表面形成致密氧化膜,A正确;通过电解使阳极金属失电子发生氧化反应,生成致密氧化膜,B正确;表面渗镀在金属表面形成钝化膜,C正确;喷涂油漆是将油漆作为涂层附着在金属表面,没有和金属发生反应,因此无法形成钝化膜,D错误。
3. (2024·1月浙江卷,3分)破损的镀锌铁皮在氨水中发生电化学腐蚀,生成$ {[Zn(NH_{3})_{4}]^{2+}} $和$ {H_{2}} $,下列说法不正确的是 (
A.氨水浓度越大,腐蚀趋势越大
B.随着腐蚀的进行,溶液的pH变大
C.铁电极上发生的电极反应式为$ {2NH_{3} + 2e^- = H_{2}↑ + 2NH^-_{2}} $
D.每生成标准状况下224 mL $ {H_{2}} $,消耗0.010 mol Zn
C
)A.氨水浓度越大,腐蚀趋势越大
B.随着腐蚀的进行,溶液的pH变大
C.铁电极上发生的电极反应式为$ {2NH_{3} + 2e^- = H_{2}↑ + 2NH^-_{2}} $
D.每生成标准状况下224 mL $ {H_{2}} $,消耗0.010 mol Zn
答案:
3.C 电化学知识

氨水浓度越大,越容易生成[Zn(NH₃)₄]²⁺,腐蚀趋势越大,A正确;由上述总反应可知,发生腐蚀过程中有OH⁻生成,溶液pH变大,B正确;由上述分析知,C错误;根据得失电子守恒,每生成标准状况下224mLH₂,转移电子为0.02mol,消耗0.010molZn,D正确。
3.C 电化学知识

氨水浓度越大,越容易生成[Zn(NH₃)₄]²⁺,腐蚀趋势越大,A正确;由上述总反应可知,发生腐蚀过程中有OH⁻生成,溶液pH变大,B正确;由上述分析知,C错误;根据得失电子守恒,每生成标准状况下224mLH₂,转移电子为0.02mol,消耗0.010molZn,D正确。
4. (2024·6月浙江卷,3分)金属腐蚀会对设备产生严重危害,腐蚀快慢与材料种类、所处环境有关。如图为两种对海水中钢闸门的防腐措施示意图:
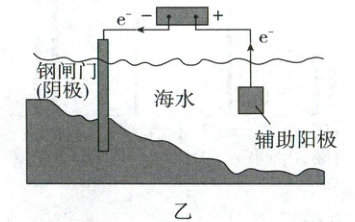
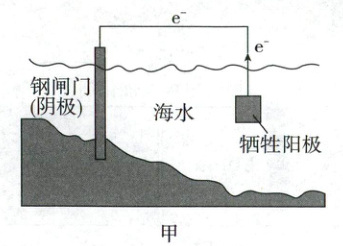
下列说法正确的是 (
A.图甲、图乙中,阳极材料本身均失去电子
B.图乙中,外加电压偏高时,钢闸门表面可发生反应$ {O_{2} + 4e^- + 2H_{2}O = 4OH^-} $
C.图乙中,外加电压保持恒定不变,有利于提高对钢闸门的防护效果
D.图甲、图乙中,当钢闸门表面的腐蚀电流为零时,钢闸门、阳极均不发生化学反应


下列说法正确的是 (
B
)A.图甲、图乙中,阳极材料本身均失去电子
B.图乙中,外加电压偏高时,钢闸门表面可发生反应$ {O_{2} + 4e^- + 2H_{2}O = 4OH^-} $
C.图乙中,外加电压保持恒定不变,有利于提高对钢闸门的防护效果
D.图甲、图乙中,当钢闸门表面的腐蚀电流为零时,钢闸门、阳极均不发生化学反应
答案:
4.B 金属的腐蚀与防护 图乙中是惰性辅助阳极,阳极材料本身不失去电子,A错误;图乙中通电后应不断调整外加电压,强制电子流向钢闸门,使其表面腐蚀电流降至零,C错误;图甲、乙中当钢闸门表面的腐蚀电流为零时阳极发生化学反应,D错误。
5. (2022·上海卷,2分)浓硫酸贮存罐的钝化金属保护法示意图如图,其原理是利用可钝化的金属与直流电源相连,控制合适的电压,使金属贮存罐表面形成致密的钝化膜,以有效减缓金属腐蚀。下列选项错误的是 (
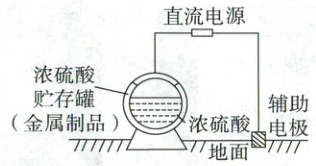
A.金属贮存罐可用钢制材料
B.电子沿导线流入辅助电极
C.贮存浓硫酸的金属罐与电源负极相连
D.电压高到一定程度有可能会加剧腐蚀
C
)
A.金属贮存罐可用钢制材料
B.电子沿导线流入辅助电极
C.贮存浓硫酸的金属罐与电源负极相连
D.电压高到一定程度有可能会加剧腐蚀
答案:
5.C 金属的腐蚀与防护 由所给装置可知,该装置为电解装置,通过电解在金属表面形成致密的钝化膜,则金属应作阳极,失去电子形成钝化膜,与直流电源的正极相连;辅助电极作阴极与电源的负极相连,据此解答。钝化膜可以有效减缓金属腐蚀,因此金属贮存罐可用钢制材料,A正确;电子由电源负极流向阴极,B正确;金属罐作阳极,与电源的正极相连,C错误;如果电压过高,则阳极金属失去电子进入溶液,会加剧腐蚀,D正确。
6. (2022·广东卷,4分)为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的3% NaCl溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是 (
A.加入$ {AgNO_{3}} $溶液产生沉淀
B.加入淀粉碘化钾溶液无蓝色出现
C.加入KSCN溶液无红色出现
D.加入$ {K_{3}[Fe(CN)_{6}]} $溶液无蓝色沉淀生成
D
)A.加入$ {AgNO_{3}} $溶液产生沉淀
B.加入淀粉碘化钾溶液无蓝色出现
C.加入KSCN溶液无红色出现
D.加入$ {K_{3}[Fe(CN)_{6}]} $溶液无蓝色沉淀生成
答案:
6.D Fe²⁺的检验 证明铁片没有被腐蚀即证明溶液中没有亚铁离子生成。加入硝酸银产生白色沉淀,只能证明有氯离子存在,A不符合题意;加入淀粉碘化钾溶液无蓝色出现,只能证明没有单质碘生成,B不符合题意;加入硫氰化钾溶液无红色出现,只能证明没有铁离子生成,C不符合题意;加入铁氰化钾溶液无蓝色沉淀生成,说明溶液中没有亚铁离子,因为亚铁离子与铁氰化钾能够生成蓝色沉淀,D符合题意;故选D。
查看更多完整答案,请扫码查看


