2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第100页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
1.【模块融合】(2025·河南卷,15分)${CaCO_{3}}$的热分解与${Ni_{x}P_{y}}$催化的${CH_{4}}$重整结合,可生产高纯度合成气(${H_{2} + CO}$),实现碳资源的二次利用。主要反应如下:
反应Ⅰ ${CaCO_{3}(s)⇌ CaO(s) + CO_{2}(g)}$ $\Delta H_{1}=+178\ kJ/mol$
反应Ⅱ ${CH_{4}(g) + CO_{2}(g)⇌ 2H_{2}(g) + 2CO(g)}$ $\Delta H_{2}=+247\ kJ/mol$
反应Ⅲ ${H_{2}(g) + CO_{2}(g)⇌ H_{2}O(g) + CO(g)}$ $\Delta H_{3}=+41\ kJ/mol$
回答下列问题:
(1)${Ca}$位于元素周期表中
(2)水分子的VSEPR模型与其空间结构模型不同,原因是
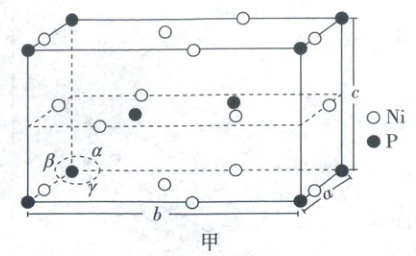
(3)${Ni_{x}P_{y}}$的晶胞如图甲所示(晶胞参数$a = b \neq c$,$\alpha = \beta = 90^{\circ}$,$\gamma = 120^{\circ}$),该物质的化学式为
(4)恒压条件下,${CH_{4}}$重整反应可以促进${CaCO_{3}}$分解,原因是
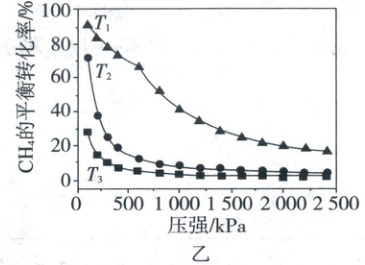
(5)在温度分别为$T_{1}$、$T_{2}$和$T_{3}$下,${CH_{4}}$的平衡转化率与压强的关系如图乙所示,反应温度最高的是
(6)一定温度、$100\ kPa$下,向体系中加入$1.0\ mol\ {CaCO_{3}}$和$1.0\ mol\ {CH_{4}}$,假设此条件下其他副反应可忽略,恒压反应至平衡时,体系中${CaCO_{3}}$转化率为$80\%$,${CH_{4}}$转化率为$60\%$,${CO}$物质的量为$1.3\ mol$,反应Ⅲ的平衡常数$K_{p} =$
已知:原位${CO_{2}}$利用率$= \dfrac{[n_{{CaCO_{3}}}(初始) - n_{{CaCO_{3}}}(平衡)] - n_{{CO_{2}}}(平衡)}{n_{{CaCO_{3}}}(初始)} × 100\%$
反应Ⅰ ${CaCO_{3}(s)⇌ CaO(s) + CO_{2}(g)}$ $\Delta H_{1}=+178\ kJ/mol$
反应Ⅱ ${CH_{4}(g) + CO_{2}(g)⇌ 2H_{2}(g) + 2CO(g)}$ $\Delta H_{2}=+247\ kJ/mol$
反应Ⅲ ${H_{2}(g) + CO_{2}(g)⇌ H_{2}O(g) + CO(g)}$ $\Delta H_{3}=+41\ kJ/mol$
回答下列问题:
(1)${Ca}$位于元素周期表中
s
区;基态${Ni^{2+}}$的价电子排布式为$3d^{8}$
。(2)水分子的VSEPR模型与其空间结构模型不同,原因是
中心原子 O 有两个孤电子对
。(3)${Ni_{x}P_{y}}$的晶胞如图甲所示(晶胞参数$a = b \neq c$,$\alpha = \beta = 90^{\circ}$,$\gamma = 120^{\circ}$),该物质的化学式为
$Ni_{2}P$
。
(4)恒压条件下,${CH_{4}}$重整反应可以促进${CaCO_{3}}$分解,原因是
$CH_{4}$重整会消耗$CO_{2}$,使反应Ⅰ平衡向右移动
。(5)在温度分别为$T_{1}$、$T_{2}$和$T_{3}$下,${CH_{4}}$的平衡转化率与压强的关系如图乙所示,反应温度最高的是
$T_{1}$
(填“$T_{1}$”“$T_{2}$”或“$T_{3}$”),原因是反应Ⅰ、Ⅱ均为吸热反应,压强一定时,升温平衡右移,$CH_{4}$的平衡转化率增大
。
(6)一定温度、$100\ kPa$下,向体系中加入$1.0\ mol\ {CaCO_{3}}$和$1.0\ mol\ {CH_{4}}$,假设此条件下其他副反应可忽略,恒压反应至平衡时,体系中${CaCO_{3}}$转化率为$80\%$,${CH_{4}}$转化率为$60\%$,${CO}$物质的量为$1.3\ mol$,反应Ⅲ的平衡常数$K_{p} =$
1.2
(保留小数点后一位),此时原位${CO_{2}}$利用率为70%
。已知:原位${CO_{2}}$利用率$= \dfrac{[n_{{CaCO_{3}}}(初始) - n_{{CaCO_{3}}}(平衡)] - n_{{CO_{2}}}(平衡)}{n_{{CaCO_{3}}}(初始)} × 100\%$
答案:
1.(15分)
(1)s $3d^{8}$
(2)中心原子 O 有两个孤电子对
(3)$Ni_{2}P$
(4)$CH_{4}$重整会消耗$CO_{2}$,使反应Ⅰ平衡向右移动
(5)$T_{1}$ 反应Ⅰ、Ⅱ均为吸热反应,压强一定时,升温平衡右移,$CH_{4}$的平衡转化率增大
(6)1.2 70%
【解析】化学反应原理综合、物质结构与性质
(1)钙位于元素周期表的ⅡA族,属于s区。基态Ni原子的价电子排布式是$3d^{8}4s^{2}$,$Ni^{2+}$的价电子排布式是$3d^{8}$。
(2)水分子的VSEPR模型是四面体形,中心原子O有两个孤电子对,水分子的空间构型是V形。
(3)Ni位于晶胞的棱上、面上和内部,P位于晶胞的顶点和内部,利用均摊法算出每个晶胞中含有6个Ni、3个P,因此该物质的化学式为$Ni_{2}P$。
(5)反应Ⅰ、Ⅱ均为吸热反应,压强一定时,升温平衡向右移动,$CH_{4}$的平衡转化率增大,从图中可看出$T_{1}$时$CH_{4}$的平衡转化率最大,因此反应温度最高的是$T_{1}$。
(6)体系达平衡时,$CaCO_{3}$的物质的量为0.2mol,CaO的物质的量为0.8mol,$CH_{4}$的物质的量为0.4mol,CO的物质的量为1.3mol,根据碳元素守恒可算出$CO_{2}$的物质的量为0.1mol,根据氧元素守恒可算出$H_{2}O(g)$的物质的量为0.1mol,根据氢元素守恒可算出$H_{2}$的物质的量为1.1mol,由于反应Ⅲ各物质的化学计量数均为1,反应前后气体分子数不变,因此可用各组分平衡时的物质的量代替平衡分压计算平衡常数[当反应前后气体分子数不变时,用平衡浓度表示的平衡常数$K_{c}$等于用平衡分压表示的平衡常数$K_{p}$,等于用平衡时的物质的量分数表示的平衡常数$K_{x}$],$K_{p}=\frac{1.3×0.1}{1.1×0.1}\approx1.2$。原位$CO_{2}$利用率=$\frac{1mol - 0.2mol - 0.1mol}{1mol}×100\%=70\%$。
(1)s $3d^{8}$
(2)中心原子 O 有两个孤电子对
(3)$Ni_{2}P$
(4)$CH_{4}$重整会消耗$CO_{2}$,使反应Ⅰ平衡向右移动
(5)$T_{1}$ 反应Ⅰ、Ⅱ均为吸热反应,压强一定时,升温平衡右移,$CH_{4}$的平衡转化率增大
(6)1.2 70%
【解析】化学反应原理综合、物质结构与性质
(1)钙位于元素周期表的ⅡA族,属于s区。基态Ni原子的价电子排布式是$3d^{8}4s^{2}$,$Ni^{2+}$的价电子排布式是$3d^{8}$。
(2)水分子的VSEPR模型是四面体形,中心原子O有两个孤电子对,水分子的空间构型是V形。
(3)Ni位于晶胞的棱上、面上和内部,P位于晶胞的顶点和内部,利用均摊法算出每个晶胞中含有6个Ni、3个P,因此该物质的化学式为$Ni_{2}P$。
(5)反应Ⅰ、Ⅱ均为吸热反应,压强一定时,升温平衡向右移动,$CH_{4}$的平衡转化率增大,从图中可看出$T_{1}$时$CH_{4}$的平衡转化率最大,因此反应温度最高的是$T_{1}$。
(6)体系达平衡时,$CaCO_{3}$的物质的量为0.2mol,CaO的物质的量为0.8mol,$CH_{4}$的物质的量为0.4mol,CO的物质的量为1.3mol,根据碳元素守恒可算出$CO_{2}$的物质的量为0.1mol,根据氧元素守恒可算出$H_{2}O(g)$的物质的量为0.1mol,根据氢元素守恒可算出$H_{2}$的物质的量为1.1mol,由于反应Ⅲ各物质的化学计量数均为1,反应前后气体分子数不变,因此可用各组分平衡时的物质的量代替平衡分压计算平衡常数[当反应前后气体分子数不变时,用平衡浓度表示的平衡常数$K_{c}$等于用平衡分压表示的平衡常数$K_{p}$,等于用平衡时的物质的量分数表示的平衡常数$K_{x}$],$K_{p}=\frac{1.3×0.1}{1.1×0.1}\approx1.2$。原位$CO_{2}$利用率=$\frac{1mol - 0.2mol - 0.1mol}{1mol}×100\%=70\%$。
查看更多完整答案,请扫码查看


