2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第36页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
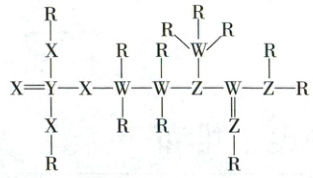
12. (2024·广东卷,4分)一种可为运动员补充能量的物质,其分子结构式如图。已知$ {R} $、$ {W} $、$ {Z} $、$ {X} $、$ {Y} $为原子序数依次增大的短周期主族元素,$ {Z} $和$ {Y} $同族,则 (
A.沸点:$ {ZR_{3}}<{YR_{3}} $
B.最高价氧化物的水化物的酸性:$ {Z}<{W} $
C.第一电离能:$ {Z}<{X}<{W} $
D.$ {ZX^{-}_{3}} $和$ {WX^{2-}_{3}} $空间结构均为平面三角形
D
)
A.沸点:$ {ZR_{3}}<{YR_{3}} $
B.最高价氧化物的水化物的酸性:$ {Z}<{W} $
C.第一电离能:$ {Z}<{X}<{W} $
D.$ {ZX^{-}_{3}} $和$ {WX^{2-}_{3}} $空间结构均为平面三角形
答案:
12.D元素周期表与元素周期律
[元素辨析]R、W、Z、X、Y为原子序数依次增大的短周期主族元素,Z和Y同族,结合Z能形成3个共价键,Y能形成5个共价键,可知Z为N元素,Y为P元素;R、W、X分别能形成1个共价键、4个共价键和2个共价键,结合原子序数大小可知R、W、X分别为H元素、C元素、O元素 。
。
$NH_{3}$中存在氢键,其分子间作用力大于$PH_{3}$,则沸点:$NH_{3}>PH_{3}$,A错误;非金属性:$C<N$,则最高价氧化物的水化物的酸性:$H_{2}CO_{3}<HNO_{3}$,B错误;第二周期主族元素,随原子序数增大,第一电离能总体呈增大趋势,但N处于2p能级半充满的稳定状态,其第一电离能大于相邻的O,则第一电离能:$N>O>C$,C错误;$NO_{3}^{-}$中心原子N的价层电子对数与$CO_{3}^{2 - }$中心原子C的价层电子对数均为3,且无孤电子对,其空间构型均为平面三角形,D正确。
12.D元素周期表与元素周期律
[元素辨析]R、W、Z、X、Y为原子序数依次增大的短周期主族元素,Z和Y同族,结合Z能形成3个共价键,Y能形成5个共价键,可知Z为N元素,Y为P元素;R、W、X分别能形成1个共价键、4个共价键和2个共价键,结合原子序数大小可知R、W、X分别为H元素、C元素、O元素
 。
。$NH_{3}$中存在氢键,其分子间作用力大于$PH_{3}$,则沸点:$NH_{3}>PH_{3}$,A错误;非金属性:$C<N$,则最高价氧化物的水化物的酸性:$H_{2}CO_{3}<HNO_{3}$,B错误;第二周期主族元素,随原子序数增大,第一电离能总体呈增大趋势,但N处于2p能级半充满的稳定状态,其第一电离能大于相邻的O,则第一电离能:$N>O>C$,C错误;$NO_{3}^{-}$中心原子N的价层电子对数与$CO_{3}^{2 - }$中心原子C的价层电子对数均为3,且无孤电子对,其空间构型均为平面三角形,D正确。
13. (2024·辽吉黑卷,3分)如下反应相关元素中,$ {W} $、$ {X} $、$ {Y} $、$ {Z} $为原子序数依次增大的短周期元素,基态$ {X} $原子的核外电子有5种空间运动状态,基态$ {Y} $、$ {Z} $原子有两个未成对电子,$ {Q} $是$ {ds} $区元素,焰色试验呈绿色。下列说法错误的是 (

A.单质沸点:$ {Z}>{Y}>{W} $
B.简单氢化物键角:$ {X}>{Y} $
C.反应过程中有蓝色沉淀产生
D.$ {QZX_{4}Y_{4}W_{12}} $是配合物,配位原子是$ {Y} $
D
)
A.单质沸点:$ {Z}>{Y}>{W} $
B.简单氢化物键角:$ {X}>{Y} $
C.反应过程中有蓝色沉淀产生
D.$ {QZX_{4}Y_{4}W_{12}} $是配合物,配位原子是$ {Y} $
答案:
13.D元素推断与物质结构 结合信息推断W、X、Y、Z、Q依次是H、N、O、S、Cu 。氢、氧、硫的单质均为分子晶体且相对分子质量依次增大,范德华力依次增强,沸点依次升高,A正确;氨分子键角$107^{\circ}$,水分子键角$105^{\circ}$,B正确;向硫酸铜溶液中通入氨气,先产生蓝色的氢氧化铜沉淀,然后沉淀再溶解得到深蓝色的$[Cu(NH_{3})_{4}]SO_{4}$溶液,C正确;$[Cu(NH_{3})_{4}]SO_{4}$中配位原子是N,D错误。
14. (2024·6月浙江卷,3分)$ {X} $、$ {Y} $、$ {Z} $、$ {M} $四种主族元素,原子序数依次增大,分别位于三个不同短周期,$ {Y} $与$ {M} $同主族,$ {Y} $与$ {Z} $核电荷数相差2,$ {Z} $的原子最外层电子数是内层电子数的3倍。下列说法不正确的是 (
A.键角:$ {YX^{+}_{3}}>{YX^{-}_{3}} $
B.分子的极性:$ {Y_{2}X_{2}}>{X_{2}Z_{2}} $
C.共价晶体熔点:$ {Y}>{M} $
D.热稳定性:$ {YX_{4}}>{MX_{4}} $
B
)A.键角:$ {YX^{+}_{3}}>{YX^{-}_{3}} $
B.分子的极性:$ {Y_{2}X_{2}}>{X_{2}Z_{2}} $
C.共价晶体熔点:$ {Y}>{M} $
D.热稳定性:$ {YX_{4}}>{MX_{4}} $
答案:
14.B元素推断
[元素辨析]X、Y、Z、M是原子序数依次增大的主族元素,且分别位于三个不同短周期,因此原子序数最小的X一定是氢元素;Z的原子最外层电子数是内层电子数的3倍,Z是氧元素;Y的核电荷数比Z小2,Y是碳元素;Y与M同主族,M是硅元素。
$CH_{3}^{+}$中C采用$sp^{2}$杂化,键角为$120^{\circ}$,$CH_{3}^{-}$中C采用$sp^{3}$杂化且有一个孤电子对,键角略小于$109^{\circ}28'$,A正确;$C_{2}H_{2}$是非极性分子,$H_{2}O_{2}$是极性分子,B错误;C的原子半径小于Si,形成的共价晶体中键长较短,键能较大,熔点较高,C正确;C的非金属性大于Si,简单氢化物的热稳定性$CH_{4}$强于$SiH_{4}$,D正确。
归纳总结
键角比较先看中心原子的杂化方式:sp杂化>$sp^{2}$杂化>$sp^{3}$杂化;中心原子杂化方式相同的再看中心原子的孤电子对数,孤电子对数越多,键角越小;如果中心原子杂化方式和孤电子对数均相同,则看元素的电负性,中心原子电负性越大或者配位原子电负性越小,键角越大。
[元素辨析]X、Y、Z、M是原子序数依次增大的主族元素,且分别位于三个不同短周期,因此原子序数最小的X一定是氢元素;Z的原子最外层电子数是内层电子数的3倍,Z是氧元素;Y的核电荷数比Z小2,Y是碳元素;Y与M同主族,M是硅元素。
$CH_{3}^{+}$中C采用$sp^{2}$杂化,键角为$120^{\circ}$,$CH_{3}^{-}$中C采用$sp^{3}$杂化且有一个孤电子对,键角略小于$109^{\circ}28'$,A正确;$C_{2}H_{2}$是非极性分子,$H_{2}O_{2}$是极性分子,B错误;C的原子半径小于Si,形成的共价晶体中键长较短,键能较大,熔点较高,C正确;C的非金属性大于Si,简单氢化物的热稳定性$CH_{4}$强于$SiH_{4}$,D正确。
归纳总结
键角比较先看中心原子的杂化方式:sp杂化>$sp^{2}$杂化>$sp^{3}$杂化;中心原子杂化方式相同的再看中心原子的孤电子对数,孤电子对数越多,键角越小;如果中心原子杂化方式和孤电子对数均相同,则看元素的电负性,中心原子电负性越大或者配位原子电负性越小,键角越大。
15. (2024·1月浙江卷,3分)$ {X} $、$ {Y} $、$ {Z} $、$ {M} $和$ {Q} $五种主族元素,原子序数依次增大,$ {X} $原子半径最小,短周期中$ {M} $电负性最小,$ {Z} $与$ {Y} $、$ {Q} $相邻,基态$ {Z} $原子的$ {s} $能级与$ {p} $能级的电子数相等,下列说法不正确的是 (
A.沸点:$ {X_{2}Z}>{X_{2}Q} $
B.$ {M} $与$ {Q} $可形成化合物$ {M_{2}Q} $、$ {M_{2}Q_{2}} $
C.化学键中离子键成分的百分数:$ {M_{2}Z}>{M_{2}Q} $
D.$ {YZ^{-}_{3}} $与$ {QZ^{2-}_{3}} $离子空间结构均为三角锥形
D
)A.沸点:$ {X_{2}Z}>{X_{2}Q} $
B.$ {M} $与$ {Q} $可形成化合物$ {M_{2}Q} $、$ {M_{2}Q_{2}} $
C.化学键中离子键成分的百分数:$ {M_{2}Z}>{M_{2}Q} $
D.$ {YZ^{-}_{3}} $与$ {QZ^{2-}_{3}} $离子空间结构均为三角锥形
答案:
15.D元素周期表和元素周期律的应用、物质结构与性质
[元素辨析]X、Y、Z、M、Q五种主族元素,原子序数依次增大,短周期中M电负性最小,则M为Na元素;基态Z原子的s能级与p能级的电子数相等,则Z为O元素;Z与Y、Q相邻,则Y为N元素,Q为S元素;X原子半径最小,则X为H元素。
$H_{2}O$分子间含有氢键,则沸点高于$H_{2}S$,A正确;Na与O形成$Na_{2}O$、$Na_{2}O_{2}$,O与S同族化学性质相似,B正确;O的电负性大于S,则O、Na之间电负性的差值大于S、Na之间电负性的差值,所以$Na_{2}O$离子键成分的百分数大于$Na_{2}S$,C正确;$NO_{3}^{-}$中N为$sp^{2}$杂化,孤电子对数为0,为平面三角形,$SO_{3}^{2 - }$中S为$sp^{3}$杂化,孤电子对数为1,呈三角锥形结构 ,D错误。
归纳总结
比较离子键成分的百分数大小的一般方法:根据形成离子键的元素的电负性大小,两者电负性相差越大,越易形成离子键,即离子键成分的百分数越大。
[元素辨析]X、Y、Z、M、Q五种主族元素,原子序数依次增大,短周期中M电负性最小,则M为Na元素;基态Z原子的s能级与p能级的电子数相等,则Z为O元素;Z与Y、Q相邻,则Y为N元素,Q为S元素;X原子半径最小,则X为H元素。
$H_{2}O$分子间含有氢键,则沸点高于$H_{2}S$,A正确;Na与O形成$Na_{2}O$、$Na_{2}O_{2}$,O与S同族化学性质相似,B正确;O的电负性大于S,则O、Na之间电负性的差值大于S、Na之间电负性的差值,所以$Na_{2}O$离子键成分的百分数大于$Na_{2}S$,C正确;$NO_{3}^{-}$中N为$sp^{2}$杂化,孤电子对数为0,为平面三角形,$SO_{3}^{2 - }$中S为$sp^{3}$杂化,孤电子对数为1,呈三角锥形结构 ,D错误。
归纳总结
比较离子键成分的百分数大小的一般方法:根据形成离子键的元素的电负性大小,两者电负性相差越大,越易形成离子键,即离子键成分的百分数越大。
16. (2024·北京卷,3分)下列依据相关数据作出的推断中,不正确的是 (
A.依据相同温度下可逆反应的$ {Q} $与$ {K} $大小的比较,可推断反应进行的方向
B.依据一元弱酸的$ K_{{a}} $,可推断它们同温度同浓度稀溶液的$ {pH} $大小
C.依据第二周期主族元素电负性依次增大,可推断它们的第一电离能依次增大
D.依据$ {F} $、$ {Cl} $、$ {Br} $、$ {I} $的氢化物分子中氢卤键的键能,可推断它们的热稳定性强弱
C
)A.依据相同温度下可逆反应的$ {Q} $与$ {K} $大小的比较,可推断反应进行的方向
B.依据一元弱酸的$ K_{{a}} $,可推断它们同温度同浓度稀溶液的$ {pH} $大小
C.依据第二周期主族元素电负性依次增大,可推断它们的第一电离能依次增大
D.依据$ {F} $、$ {Cl} $、$ {Br} $、$ {I} $的氢化物分子中氢卤键的键能,可推断它们的热稳定性强弱
答案:
16.C化学反应原理及物质结构与性质 一元弱酸的$K_{a}$越大,同温度同浓度稀溶液的酸性越强,电离出的$H^{+}$越多,pH越小,B不符合题意;电负性为吸引电子的能力,而电离能为失去电子的能力,所以同一周期从左到右,第一电离能是增大的趋势,但是ⅡA大于ⅢA,ⅤA大于ⅥA,C符合题意;F、Cl、Br、I的氢化物分子中氢卤键的键能越大,氢化物的热稳定性越强,D不符合题意。
归纳总结
对于可逆反应的Q与K的关系:$Q>K$,反应向逆反应方向进行;$Q<K$,反应向正反应方向进行;$Q=K$,反应处于平衡状态。
归纳总结
对于可逆反应的Q与K的关系:$Q>K$,反应向逆反应方向进行;$Q<K$,反应向正反应方向进行;$Q=K$,反应处于平衡状态。
17. (2024·湖北卷,3分)主族元素$ {W} $、$ {X} $、$ {Y} $、$ {Z} $原子序数依次增大,$ {X} $、$ {Y} $的价层电子数相等,$ {Z} $的价层电子所在能层有16个轨道,4种元素形成的化合物如图。下列说法正确的是 (
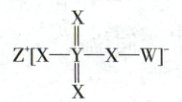
A.电负性:$ {W}>{Y} $
B.酸性:$ {W_{2}YX_{3}}>{W_{2}YX_{4}} $
C.基态原子的未成对电子数:$ {W}>{X} $
D.氧化物溶于水所得溶液的$ {pH} $:$ {Z}>{Y} $
D
)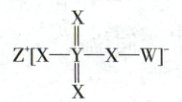
A.电负性:$ {W}>{Y} $
B.酸性:$ {W_{2}YX_{3}}>{W_{2}YX_{4}} $
C.基态原子的未成对电子数:$ {W}>{X} $
D.氧化物溶于水所得溶液的$ {pH} $:$ {Z}>{Y} $
答案:
17.D元素推断和元素周期律
[元素推断]X、Y的价层电子数目相等,说明X和Y位于同主族,且X能形成2条键,推测X为O元素,Y为S元素,Z的价层电子所在能层有16个轨道,说明Z的价电子位于N层,且Z形成+1价阳离子,Z为主族元素,因此推测Z为K元素,W形成1条键且原子序数小于O,推测W为H元素,四种元素形成的化合物为$KHSO_{4}$。
S的电负性强于H,A错误;$H_{2}SO_{3}$为弱酸,$H_{2}SO_{4}$为强酸,酸性:$H_{2}SO_{4}>H_{2}SO_{3}$,B错误;H的未成对电子为1个,O的未成对电子为2个,C错误;$K_{2}O$溶于水形成KOH,显碱性,S的氧化物$SO_{2}$、$SO_{3}$溶于水均形成酸,因此pH:$Z>Y$,D正确。
[元素推断]X、Y的价层电子数目相等,说明X和Y位于同主族,且X能形成2条键,推测X为O元素,Y为S元素,Z的价层电子所在能层有16个轨道,说明Z的价电子位于N层,且Z形成+1价阳离子,Z为主族元素,因此推测Z为K元素,W形成1条键且原子序数小于O,推测W为H元素,四种元素形成的化合物为$KHSO_{4}$。
S的电负性强于H,A错误;$H_{2}SO_{3}$为弱酸,$H_{2}SO_{4}$为强酸,酸性:$H_{2}SO_{4}>H_{2}SO_{3}$,B错误;H的未成对电子为1个,O的未成对电子为2个,C错误;$K_{2}O$溶于水形成KOH,显碱性,S的氧化物$SO_{2}$、$SO_{3}$溶于水均形成酸,因此pH:$Z>Y$,D正确。
18. (2023·6月浙江卷,3分)$ {X} $、$ {Y} $、$ {Z} $、$ {M} $、$ {Q} $五种短周期元素,原子序数依次增大。$ {X} $的$ 2{s} $轨道全充满,$ {Y} $的$ {s} $能级电子数量是$ {p} $能级的两倍,$ {M} $是地壳中含量最多的元素,$ {Q} $是纯碱中的一种元素。下列说法不正确的是 (
A.电负性:$ {Z}>{X} $
B.最高正价:$ {Z}<{M} $
C.$ {Q} $与$ {M} $的化合物中可能含有非极性共价键
D.最高价氧化物对应水化物的酸性:$ {Z}>{Y} $
B
)A.电负性:$ {Z}>{X} $
B.最高正价:$ {Z}<{M} $
C.$ {Q} $与$ {M} $的化合物中可能含有非极性共价键
D.最高价氧化物对应水化物的酸性:$ {Z}>{Y} $
答案:
18.B元素周期表与元素周期律
[元素辨析]Y的原子序数大于X,Y的s能级电子数量是p能级的两倍,Y为碳元素,X的2s轨道全充满,则X为铍或硼元素,M是地壳中含量最多的元素,M为氧元素,则Z为氮元素,Q是纯碱中的一种元素,Q为钠元素。
电负性:N大于B或Be,A正确;O没有最高正价,B错误;氧和钠可以形成过氧化钠,过氧化钠中含有非极性共价键,C正确;非金属性$N>C$,最高价氧化物对应水化物的酸性:$HNO_{3}>H_{2}CO_{3}$,D正确。
[元素辨析]Y的原子序数大于X,Y的s能级电子数量是p能级的两倍,Y为碳元素,X的2s轨道全充满,则X为铍或硼元素,M是地壳中含量最多的元素,M为氧元素,则Z为氮元素,Q是纯碱中的一种元素,Q为钠元素。
电负性:N大于B或Be,A正确;O没有最高正价,B错误;氧和钠可以形成过氧化钠,过氧化钠中含有非极性共价键,C正确;非金属性$N>C$,最高价氧化物对应水化物的酸性:$HNO_{3}>H_{2}CO_{3}$,D正确。
查看更多完整答案,请扫码查看


