2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第39页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
1. (2025·河北卷,3分)下列化学用语表述正确的是 (
A.中子数为12的氖核素:${_{12}^{22}Ne}$
B.氯化镁的电子式: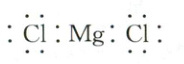
C.甲醛分子的球棍模型: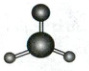
D.${CO^{2-}_{3}}$的价层电子对互斥模型: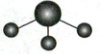
C
)A.中子数为12的氖核素:${_{12}^{22}Ne}$
B.氯化镁的电子式:
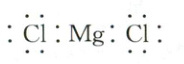
C.甲醛分子的球棍模型:

D.${CO^{2-}_{3}}$的价层电子对互斥模型:

答案:
1.C 化学用语 质量数=质子数+中子数,Ne为10号元素,所以中子数为12的氖核素表示为$_{10}^{22}Ne$,A错误;氯化镁为离子化合物,电子式为$[: \ddot{Cl}: ]^-Mg^{2+}[: \ddot{Cl}: ]^-$,B错误;甲醛分子结构式为$H—C(H)=O$,含1个$C=O$双键,2个$C—H$单键,且原子半径$C>O>H$,C项正确;$CO_3^{2-}$中心原子C原子的价层电子对数为$3+\frac{4 + 2 - 3 × 2}{2}=3$,含3个$\sigma$键,无孤电子对,为平面三角形结构,D项错误。
2. (2025·辽吉黑内蒙古卷,3分)侯氏制碱法突破西方技术垄断,推动了世界制碱技术的发展,其主要反应为${NaCl + CO_{2} + NH_{3} + H_{2}O = NaHCO_{3}\downarrow + NH_{4}Cl}$。下列有关化学用语或说法正确的是 (
A.${CO_{2}}$的电子式:${:\overset{..}{O}::\overset{..}{C}::\overset{..}{O}:}$
B.${H_{2}O}$的空间结构:直线形
C.${NH_{4}Cl}$的晶体类型:离子晶体
D.溶解度:${NaHCO_{3} > NH_{4}HCO_{3}}$
C
)A.${CO_{2}}$的电子式:${:\overset{..}{O}::\overset{..}{C}::\overset{..}{O}:}$
B.${H_{2}O}$的空间结构:直线形
C.${NH_{4}Cl}$的晶体类型:离子晶体
D.溶解度:${NaHCO_{3} > NH_{4}HCO_{3}}$
答案:
2.C 化学用语 $CO_2$的电子式为$O::C::O:$,A错误;$H_2O$的中心原子O的价层电子对数为4,含有2个孤电子对,空间结构为V形,B错误;$NaHCO_3$溶解度小于$NH_4HCO_3$(铵根离子的半径大于钠离子,使得$NaHCO_3$的离子键强度大于$NH_4HCO_3$,也可根据侯氏制碱法进行判断),D错误。
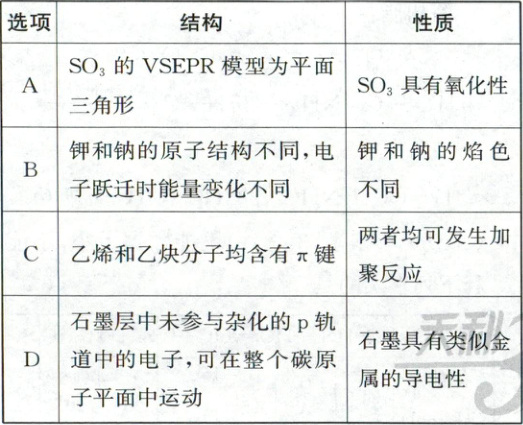
3. (2025·广东卷,3分)由结构不能推测出对应性质的是 (
A
)
答案:
3.A 物质的结构与性质 $SO_3$的空间结构不能推测出其具有氧化性,A错误。
4. (2025·湖北卷,3分)N和P为同主族相邻元素。下列关于物质性质或现象的解释错误的是 (
A.${KNO_{3}}$的熔点比${K_{3}PO_{4}}$的低,因为${KNO_{3}}$的离子键更强
B.磷单质通常不以${P_{2}}$形式存在,因为磷磷之间难以形成三键
C.次磷酸 比硝酸
比硝酸 的酸性弱,因为前者的${H - O}$键极性小
的酸性弱,因为前者的${H - O}$键极性小
D.P形成${PF_{5}}$而N形成${NF_{3}}$,因为P的价层电子轨道更多且半径更大
A
)A.${KNO_{3}}$的熔点比${K_{3}PO_{4}}$的低,因为${KNO_{3}}$的离子键更强
B.磷单质通常不以${P_{2}}$形式存在,因为磷磷之间难以形成三键
C.次磷酸
 比硝酸
比硝酸 的酸性弱,因为前者的${H - O}$键极性小
的酸性弱,因为前者的${H - O}$键极性小D.P形成${PF_{5}}$而N形成${NF_{3}}$,因为P的价层电子轨道更多且半径更大
答案:
4.A 物质结构与性质 $NO_3^-$带1个负电荷,$PO_4^{3-}$带3个负电荷,因此$K^+$和$PO_4^{3-}$之间的离子键更强,$K_3PO_4$熔点更高,A错误;P原子半径较大,P与P形成$\sigma$键后,p轨道难以重叠形成三键,因此磷单质通常不以$P_2$形式存在,B正确;两种酸的中心原子电负性大小关系为$N>P$,电负性强的原子对$O—H$键极性影响更大,因此$HNO_3$中$H—O$键极性更大,更容易电离出$H^+$,故硝酸的酸性更强,C正确;N和P均存在5个价电子,一般形成3根键,P原子能够形成$PF_5$的原因是P的半径大,且存在3d轨道,D正确。
(2025·安徽卷,6分)阅读下列材料,完成5,6小题。
氨是其他含氮化合物的生产原料。氨可在氧气中燃烧生成${N_{2}}$。金属钠的液氨溶液放置时缓慢放出气体,同时生成${NaNH_{2}}$。${NaNH_{2}}$遇水转化为${NaOH}$。${Cu(OH)_{2}}$溶于氨水得到深蓝色${[Cu(NH_{3})_{4}](OH)_{2}}$溶液,加入稀硫酸又转化为蓝色${[Cu(H_{2}O)_{4}]SO_{4}}$溶液。氨可以发生类似于水解反应的氨解反应,浓氨水与${HgCl_{2}}$溶液反应生成${Hg(NH_{2})Cl}$沉淀。
5. 下列有关反应的化学方程式错误的是 (
A. 氨在氧气中燃烧:${4NH_{3} + 3O_{2} \xlongequal{点燃} 2N_{2} + 6H_{2}O}$
B. 液氨与金属钠反应:${2Na + 2NH_{3}(l) = 2NaNH_{2} + H_{2}\uparrow}$
C. 氨水溶解${Cu(OH)_{2}}$:${Cu(OH)_{2} + 4NH_{3} = [Cu(NH_{3})_{4}](OH)_{2}}$
D. 浓氨水与${HgCl_{2}}$反应:${HgCl_{2} + NH_{3} = Hg(NH_{2})Cl\downarrow + HCl}$
★6. 下列有关物质结构或性质的比较中,正确的是 (
A. 与${H^{+}}$结合的能力:${OH^{-} > NH^{-}_{2}}$
B. 与氨形成配位键的能力:${H^{+} > Cu^{2+}}$
C. ${H_{2}O}$和${NH_{3}}$分子中的键长:${O - H > N - H}$
D. 微粒所含电子数:${NH^{+}_{4} > NH^{-}_{2}}$
氨是其他含氮化合物的生产原料。氨可在氧气中燃烧生成${N_{2}}$。金属钠的液氨溶液放置时缓慢放出气体,同时生成${NaNH_{2}}$。${NaNH_{2}}$遇水转化为${NaOH}$。${Cu(OH)_{2}}$溶于氨水得到深蓝色${[Cu(NH_{3})_{4}](OH)_{2}}$溶液,加入稀硫酸又转化为蓝色${[Cu(H_{2}O)_{4}]SO_{4}}$溶液。氨可以发生类似于水解反应的氨解反应,浓氨水与${HgCl_{2}}$溶液反应生成${Hg(NH_{2})Cl}$沉淀。
5. 下列有关反应的化学方程式错误的是 (
D
)A. 氨在氧气中燃烧:${4NH_{3} + 3O_{2} \xlongequal{点燃} 2N_{2} + 6H_{2}O}$
B. 液氨与金属钠反应:${2Na + 2NH_{3}(l) = 2NaNH_{2} + H_{2}\uparrow}$
C. 氨水溶解${Cu(OH)_{2}}$:${Cu(OH)_{2} + 4NH_{3} = [Cu(NH_{3})_{4}](OH)_{2}}$
D. 浓氨水与${HgCl_{2}}$反应:${HgCl_{2} + NH_{3} = Hg(NH_{2})Cl\downarrow + HCl}$
★6. 下列有关物质结构或性质的比较中,正确的是 (
B
)A. 与${H^{+}}$结合的能力:${OH^{-} > NH^{-}_{2}}$
B. 与氨形成配位键的能力:${H^{+} > Cu^{2+}}$
C. ${H_{2}O}$和${NH_{3}}$分子中的键长:${O - H > N - H}$
D. 微粒所含电子数:${NH^{+}_{4} > NH^{-}_{2}}$
答案:
5.D 化学方程式的正误判断 氨可以发生类似于水解反应的氨解反应$2NH_3 \rightleftharpoons NH_2^- + NH_4^+$,浓氨水与$HgCl_2$溶液反应生成$Hg(NH_2)Cl$沉淀的化学方程式为$HgCl_2 + 2NH_3 \rightleftharpoons Hg(NH_2)Cl \downarrow + NH_4Cl$,D错误。
6.B 物质的结构与性质 由题意可知$NaNH_2$遇水转化为$NaOH$,发生反应$NH_2^- + H_2O \rightleftharpoons NH_3 \uparrow + OH^-$,则与$H^+$结合的能力$OH^-<NH_2^-$,A错误;根据$[Cu(NH_3)_4](OH)_2$溶液加入稀硫酸转化为蓝色$[Cu(H_2O)_4]SO_4$溶液,发生反应$[Cu(NH_3)_4]^{2+} + 4H^+ + 4H_2O \rightleftharpoons [Cu(H_2O)_4]^{2+} + 4NH_4^+$,可知与氨形成配位键的能力$H^+>Cu^{2+}$,B正确;O的原子半径小于N,则$H_2O$和$NH_3$分子中的键长$O—H<N—H$,C错误;$NH_4^+$和$NH_2^-$均含10个电子,D错误。
6.B 物质的结构与性质 由题意可知$NaNH_2$遇水转化为$NaOH$,发生反应$NH_2^- + H_2O \rightleftharpoons NH_3 \uparrow + OH^-$,则与$H^+$结合的能力$OH^-<NH_2^-$,A错误;根据$[Cu(NH_3)_4](OH)_2$溶液加入稀硫酸转化为蓝色$[Cu(H_2O)_4]SO_4$溶液,发生反应$[Cu(NH_3)_4]^{2+} + 4H^+ + 4H_2O \rightleftharpoons [Cu(H_2O)_4]^{2+} + 4NH_4^+$,可知与氨形成配位键的能力$H^+>Cu^{2+}$,B正确;O的原子半径小于N,则$H_2O$和$NH_3$分子中的键长$O—H<N—H$,C错误;$NH_4^+$和$NH_2^-$均含10个电子,D错误。
查看更多完整答案,请扫码查看


