2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第22页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
5.(2025·河南卷,14分)一种从预处理得到的贵金属合金粉[主要成分为${Fe}$、${Rh}$(铑)、${Pt}$,含有少量${SiO_{2}}$]中尽可能回收铑的工艺流程如下:
回答下列问题:
(1)“酸溶1”的目的是
(2)已知“酸溶2”中${Rh}$转化为${H_{3}[RhCl_{6}]}$,则生成该物质的化学方程式为
(3)“沉铑”中得到的沉淀经“灼烧”后分解成铑单质,但夹杂少量${Rh_{2}O_{3}}$和${RhCl_{3}}$,则“高温还原”中发生反应的化学方程式为
(4)若“活化还原”在室温下进行,${SnCl_{2}}$初始浓度为$1.0× 10^{-4}\ mol/L$,为避免生成${Sn(OH)_{2}}$沉淀,溶液适宜的${pH}$为
[已知${Sn(OH)_{2}}$的$K_{sp}=5.5× 10^{-28}$]。
A. 2.0
B. 4.0
C. 6.0
(5)“活化还原”中,${SnCl_{2}}$必须过量,其与${Rh}$(Ⅲ)反应可生成${[Rh(SnCl_{5})_{3}]^{4-}}$,提升了${Rh}$的还原速率,该配离子中${Rh}$的化合价为
(6)“酸溶3”的目的是
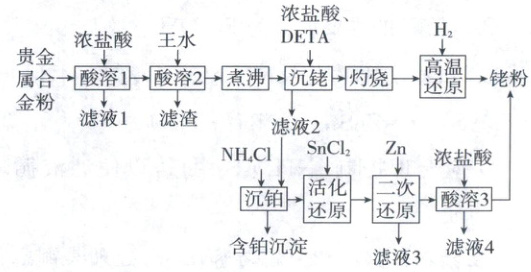
回答下列问题:
(1)“酸溶1”的目的是
除去铁
。(2)已知“酸溶2”中${Rh}$转化为${H_{3}[RhCl_{6}]}$,则生成该物质的化学方程式为
Rh + HNO_3 + 6HCl = H[RhCl_6] + NO ↑ + 2H_2O
;“滤渣”的主要成分是SiO_2
(填化学式)。(3)“沉铑”中得到的沉淀经“灼烧”后分解成铑单质,但夹杂少量${Rh_{2}O_{3}}$和${RhCl_{3}}$,则“高温还原”中发生反应的化学方程式为
Rh_2O_3 + 3H_2 \xlongequal{高温} 2Rh + 3H_2O、2RhCl_3 + 3H_2 \xlongequal{高温} 2Rh + 6HCl
。(4)若“活化还原”在室温下进行,${SnCl_{2}}$初始浓度为$1.0× 10^{-4}\ mol/L$,为避免生成${Sn(OH)_{2}}$沉淀,溶液适宜的${pH}$为
A
(填标号)[已知${Sn(OH)_{2}}$的$K_{sp}=5.5× 10^{-28}$]。
A. 2.0
B. 4.0
C. 6.0
(5)“活化还原”中,${SnCl_{2}}$必须过量,其与${Rh}$(Ⅲ)反应可生成${[Rh(SnCl_{5})_{3}]^{4-}}$,提升了${Rh}$的还原速率,该配离子中${Rh}$的化合价为
+1
;反应中同时生成${[SnCl_{6}]^{2-}}$,${Rh}$(Ⅲ)以${[RhCl_{6}]^{3-}}$计,则理论上${SnCl_{2}}$和${Rh}$(Ⅲ)反应的物质的量之比为6:1
。(6)“酸溶3”的目的是
将过量的Zn和生成的Sn除去
。
答案:
5.(14分)
(1)除去铁
(2)$\mathrm{Rh + HNO_3 + 6HCl = H[RhCl_6] + NO \uparrow + 2H_2O SiO_2}$
(3)$\mathrm{Rh_2O_3 + 3H_2 \xlongequal{高温} 2Rh + 3H_2O、2RhCl_3 + 3H_2 \xlongequal{高温} 2Rh + 6HCl}$
(4)A
(5)+1 6:1
(6)将过量的Zn和生成的Sn除去

【解析】回收铑的工艺流程
(1)“酸溶1”的目的是除去合金粉中的铁,使其与贵金属分离。
(2)“酸溶2”中王水将铂、铑溶解,剩余“滤渣”的主要成分是$\mathrm{SiO_2}$。
(3)“高温还原”时,氢气将$\mathrm{Rh_2O_3}$和$\mathrm{RhCl_3}$还原为单质铑,化学方程式为$\mathrm{Rh_2O_3 + 3H_2 \xlongequal{高温} 2Rh + 3H_2O}$、$\mathrm{2RhCl_3 + 3H_2 \xlongequal{高温} 2Rh + 6HCl}$。
(4)$\mathrm{Sn^{2+}}$的初始浓度为$1.0 × 10^{-4} mol/L$,根据$\mathrm{Sn(OH)_2}$的溶度积可算出产生沉淀所需的$\mathrm{OH^-}$最小浓度约为$2.3 × 10^{-12} mol/L$,此时$\mathrm{H^+}$浓度约为$4.3 × 10^{-3} mol/L$,为避免生成$\mathrm{Sn(OH)_2}$沉淀,溶液中$\mathrm{H^+}$浓度应大于$4.3 × 10^{-3} mol/L$,溶液pH应小于$-\lg 4.3 × 10^{-3} \approx 2.4$,选项中符合要求的只有A。
(5)$\mathrm{[Rh(SnCl_3)_5]^{4-}}$中Sn是+2价,Cl是 - 1价,可算出Rh是+1价。结合题意可知,$\mathrm{Rh(Ⅲ) \sim SnCl_2 \sim 2e^-}$,假设有1 mol $\mathrm{Rh(Ⅲ)}$参加反应,则消耗1 mol $\mathrm{SnCl_2}$,$\mathrm{SnCl_2}$与1 mol $\mathrm{Rh(Ⅰ)}$形成配离子时消耗的物质的量为5 mol,故共消耗6 mol $\mathrm{SnCl_2}$,因此理论上$\mathrm{SnCl_2}$和$\mathrm{Rh(Ⅲ)}$反应的物质的量之比为6:1。
(6)“酸溶3”的目的是除去过量的Zn和生成的Sn,得到纯净的铑粉。
5.(14分)
(1)除去铁
(2)$\mathrm{Rh + HNO_3 + 6HCl = H[RhCl_6] + NO \uparrow + 2H_2O SiO_2}$
(3)$\mathrm{Rh_2O_3 + 3H_2 \xlongequal{高温} 2Rh + 3H_2O、2RhCl_3 + 3H_2 \xlongequal{高温} 2Rh + 6HCl}$
(4)A
(5)+1 6:1
(6)将过量的Zn和生成的Sn除去

【解析】回收铑的工艺流程
(1)“酸溶1”的目的是除去合金粉中的铁,使其与贵金属分离。
(2)“酸溶2”中王水将铂、铑溶解,剩余“滤渣”的主要成分是$\mathrm{SiO_2}$。
(3)“高温还原”时,氢气将$\mathrm{Rh_2O_3}$和$\mathrm{RhCl_3}$还原为单质铑,化学方程式为$\mathrm{Rh_2O_3 + 3H_2 \xlongequal{高温} 2Rh + 3H_2O}$、$\mathrm{2RhCl_3 + 3H_2 \xlongequal{高温} 2Rh + 6HCl}$。
(4)$\mathrm{Sn^{2+}}$的初始浓度为$1.0 × 10^{-4} mol/L$,根据$\mathrm{Sn(OH)_2}$的溶度积可算出产生沉淀所需的$\mathrm{OH^-}$最小浓度约为$2.3 × 10^{-12} mol/L$,此时$\mathrm{H^+}$浓度约为$4.3 × 10^{-3} mol/L$,为避免生成$\mathrm{Sn(OH)_2}$沉淀,溶液中$\mathrm{H^+}$浓度应大于$4.3 × 10^{-3} mol/L$,溶液pH应小于$-\lg 4.3 × 10^{-3} \approx 2.4$,选项中符合要求的只有A。
(5)$\mathrm{[Rh(SnCl_3)_5]^{4-}}$中Sn是+2价,Cl是 - 1价,可算出Rh是+1价。结合题意可知,$\mathrm{Rh(Ⅲ) \sim SnCl_2 \sim 2e^-}$,假设有1 mol $\mathrm{Rh(Ⅲ)}$参加反应,则消耗1 mol $\mathrm{SnCl_2}$,$\mathrm{SnCl_2}$与1 mol $\mathrm{Rh(Ⅰ)}$形成配离子时消耗的物质的量为5 mol,故共消耗6 mol $\mathrm{SnCl_2}$,因此理论上$\mathrm{SnCl_2}$和$\mathrm{Rh(Ⅲ)}$反应的物质的量之比为6:1。
(6)“酸溶3”的目的是除去过量的Zn和生成的Sn,得到纯净的铑粉。
6.(2024·辽吉黑卷,14分)中国是世界上最早利用细菌冶金的国家。已知金属硫化物在“细菌氧化”时转化为硫酸盐,某工厂用细菌冶金技术处理载金硫化矿粉(其中细小的${Au}$颗粒被${FeS_{2}}$、${FeAsS}$包裹),以提高金的浸出率并冶炼金,工艺流程如下:
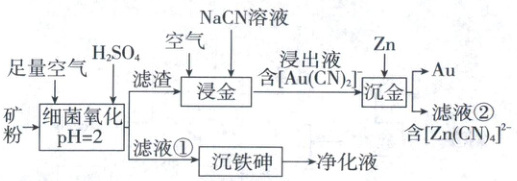
回答下列问题:
(1)北宋时期我国就有多处矿场利用细菌氧化形成的天然“胆水”冶炼铜,“胆水”的主要溶质为
(2)“细菌氧化”中,${FeS_{2}}$发生反应的离子方程式为
(3)“沉铁砷”时需加碱调节${pH}$,生成
(4)“焙烧氧化”也可提高“浸金”效率,相比“焙烧氧化”,“细菌氧化”的优势为
A. 无需控温
B. 可减少有害气体产生
C. 设备无需耐高温
D. 不产生废液废渣
(5)“真金不怕火炼”表明${Au}$难被${O_{2}}$氧化,“浸金”中${NaCN}$的作用为
(6)“沉金”中${Zn}$的作用为
(7)滤液②经${H_{2}SO_{4}}$酸化,${[Zn(CN)_{4}]^{2-}}$转化为${ZnSO_{4}}$和${HCN}$的化学方程式为

回答下列问题:
(1)北宋时期我国就有多处矿场利用细菌氧化形成的天然“胆水”冶炼铜,“胆水”的主要溶质为
CuSO_4
(填化学式)。(2)“细菌氧化”中,${FeS_{2}}$发生反应的离子方程式为
4FeS_2 + 15O_2 + 2H_2O \xlongequal{细菌} 4Fe^{3+} + 8SO_4^{2-} + 4H^+
。(3)“沉铁砷”时需加碱调节${pH}$,生成
Fe(OH)_3
(填化学式)胶体起絮凝作用,促进了含${As}$微粒的沉降。(4)“焙烧氧化”也可提高“浸金”效率,相比“焙烧氧化”,“细菌氧化”的优势为
BC
(填标号)。A. 无需控温
B. 可减少有害气体产生
C. 设备无需耐高温
D. 不产生废液废渣
(5)“真金不怕火炼”表明${Au}$难被${O_{2}}$氧化,“浸金”中${NaCN}$的作用为
提供CN^-,使其与Au^+形成配离子,提高Au的还原性
。(6)“沉金”中${Zn}$的作用为
作还原剂,置换出Au
。(7)滤液②经${H_{2}SO_{4}}$酸化,${[Zn(CN)_{4}]^{2-}}$转化为${ZnSO_{4}}$和${HCN}$的化学方程式为
Na_2[Zn(CN)_4] + 2H_2SO_4 = ZnSO_4 + 4HCN + Na_2SO_4
。用碱中和${HCN}$可生成NaCN
(填溶质化学式)溶液,从而实现循环利用。
答案:
6.(14分)
(1)$\mathrm{CuSO_4}$
(2)$4\mathrm{FeS_2 + 15O_2 + 2H_2O \xlongequal{细菌} 4Fe^{3+} + 8SO_4^{2-} + 4H^+}$
(3)$\mathrm{Fe(OH)_3}$
(4)BC
(5)提供$\mathrm{CN^-}$,使其与$\mathrm{Au^+}$形成配离子,提高$\mathrm{Au}$的还原性
(6)作还原剂,置换出$\mathrm{Au}$
(7)$\mathrm{Na_2[Zn(CN)_4] + 2H_2SO_4 = ZnSO_4 + 4HCN + Na_2SO_4}$;$\mathrm{NaCN}$
【解析】工艺流程分析
(1)用“胆水”冶炼铜,即用$\mathrm{Fe}$置换出$\mathrm{CuSO_4}$溶液中的$\mathrm{Cu}$,因此“胆水”的主要溶质为$\mathrm{CuSO_4}$。
(2)“细菌氧化”过程中,$\mathrm{FeS_2}$被氧化,$\mathrm{Fe^{2+}}$会生成$\mathrm{Fe^{3+}}$,$\mathrm{S^{2-}}$会被氧化为$\mathrm{SO_4^{2-}}$,因此离子方程式为$4\mathrm{FeS_2 + 15O_2 + 2H_2O \xlongequal{细菌} 4Fe^{3+} + 8SO_4^{2-} + 4H^+}$。
(3)①中的$\mathrm{Fe}$元素的存在形式为$\mathrm{Fe(OH)_3}$,$\mathrm{Fe(OH)_3}$会形成$\mathrm{Fe(OH)_3}$胶体,起絮凝作用,促进含As微粒的沉降。
(4)“焙烧氧化”时,需要高温加热,同时$\mathrm{S}$元素会转化为$\mathrm{SO_2}$,而“细菌氧化”仅需要在常温下即可,且$\mathrm{S}$元素直接转化为硫酸盐,因此相对而言,细菌氧化可减少有害气体产生,不需要耐高温设备,但是细菌的生存温度有限制,因此需要控制反应的温度在适合细菌生存的范围内,由题干流程可知两种氧化过程都会产生废液和废渣,所以优势包括BC。
(5)从流程信息中可以看到,通入空气加入$\mathrm{NaCN}$溶液后,$\mathrm{Au}$转化为$\mathrm{[Au(CN)_2]^-}$,可以看出$\mathrm{CN^-}$可以和$\mathrm{Au}$形成稳定的配离子,因此$\mathrm{NaCN}$的作用为提供$\mathrm{CN^-}$,使其与$\mathrm{Au^+}$形成配离子,提高$\mathrm{Au}$的还原性。
(6)在“沉金”步骤中,加入$\mathrm{Zn}$后化合态的$\mathrm{Au}$被还原为单质$\mathrm{Au}$,因此$\mathrm{Zn}$的作用是作还原剂,置换出$\mathrm{Au}$。
(7)$\mathrm{Na_2[Zn(CN)_4]}$在$\mathrm{H_2SO_4}$酸化下可以转化为$\mathrm{ZnSO_4}$和$\mathrm{HCN}$,化学方程式为$\mathrm{Na_2[Zn(CN)_4] + 2H_2SO_4 = ZnSO_4 + 4HCN + Na_2SO_4}$;若用碱中和$\mathrm{HCN}$达到循环利用的目的,则需要使用$\mathrm{NaOH}$溶液进行中和,生成$\mathrm{NaCN}$。
(1)$\mathrm{CuSO_4}$
(2)$4\mathrm{FeS_2 + 15O_2 + 2H_2O \xlongequal{细菌} 4Fe^{3+} + 8SO_4^{2-} + 4H^+}$
(3)$\mathrm{Fe(OH)_3}$
(4)BC
(5)提供$\mathrm{CN^-}$,使其与$\mathrm{Au^+}$形成配离子,提高$\mathrm{Au}$的还原性
(6)作还原剂,置换出$\mathrm{Au}$
(7)$\mathrm{Na_2[Zn(CN)_4] + 2H_2SO_4 = ZnSO_4 + 4HCN + Na_2SO_4}$;$\mathrm{NaCN}$
【解析】工艺流程分析
(1)用“胆水”冶炼铜,即用$\mathrm{Fe}$置换出$\mathrm{CuSO_4}$溶液中的$\mathrm{Cu}$,因此“胆水”的主要溶质为$\mathrm{CuSO_4}$。
(2)“细菌氧化”过程中,$\mathrm{FeS_2}$被氧化,$\mathrm{Fe^{2+}}$会生成$\mathrm{Fe^{3+}}$,$\mathrm{S^{2-}}$会被氧化为$\mathrm{SO_4^{2-}}$,因此离子方程式为$4\mathrm{FeS_2 + 15O_2 + 2H_2O \xlongequal{细菌} 4Fe^{3+} + 8SO_4^{2-} + 4H^+}$。
(3)①中的$\mathrm{Fe}$元素的存在形式为$\mathrm{Fe(OH)_3}$,$\mathrm{Fe(OH)_3}$会形成$\mathrm{Fe(OH)_3}$胶体,起絮凝作用,促进含As微粒的沉降。
(4)“焙烧氧化”时,需要高温加热,同时$\mathrm{S}$元素会转化为$\mathrm{SO_2}$,而“细菌氧化”仅需要在常温下即可,且$\mathrm{S}$元素直接转化为硫酸盐,因此相对而言,细菌氧化可减少有害气体产生,不需要耐高温设备,但是细菌的生存温度有限制,因此需要控制反应的温度在适合细菌生存的范围内,由题干流程可知两种氧化过程都会产生废液和废渣,所以优势包括BC。
(5)从流程信息中可以看到,通入空气加入$\mathrm{NaCN}$溶液后,$\mathrm{Au}$转化为$\mathrm{[Au(CN)_2]^-}$,可以看出$\mathrm{CN^-}$可以和$\mathrm{Au}$形成稳定的配离子,因此$\mathrm{NaCN}$的作用为提供$\mathrm{CN^-}$,使其与$\mathrm{Au^+}$形成配离子,提高$\mathrm{Au}$的还原性。
(6)在“沉金”步骤中,加入$\mathrm{Zn}$后化合态的$\mathrm{Au}$被还原为单质$\mathrm{Au}$,因此$\mathrm{Zn}$的作用是作还原剂,置换出$\mathrm{Au}$。
(7)$\mathrm{Na_2[Zn(CN)_4]}$在$\mathrm{H_2SO_4}$酸化下可以转化为$\mathrm{ZnSO_4}$和$\mathrm{HCN}$,化学方程式为$\mathrm{Na_2[Zn(CN)_4] + 2H_2SO_4 = ZnSO_4 + 4HCN + Na_2SO_4}$;若用碱中和$\mathrm{HCN}$达到循环利用的目的,则需要使用$\mathrm{NaOH}$溶液进行中和,生成$\mathrm{NaCN}$。
查看更多完整答案,请扫码查看


