2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第48页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
1. (2025·1月浙江卷,节选,7分)磷是生命活动中不可或缺的元素。
请回答:
(1)关于ⅤA族元素原子结构的描述,下列说法正确的是
A. 基态P原子3p轨道上的电子自旋方向相同
B. ${As^{3+}}$的最外层电子数为18
C. ${P^{3+}}$的半径小于${P^{5+}}$的半径
D. 电子排布为${[Ne] 3s^1 3p^4}$的P原子处于激发态
(2)某化合物的晶胞如图。
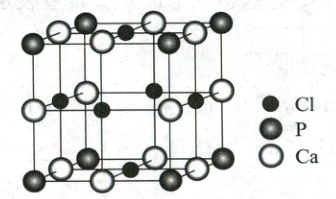
①化学式是
②将0.01 mol该化合物加入到含少量石蕊的10 mL ${H_{2}O}$中,实验现象是
(3)两分子${H_{3}PO_{4}}$($K_{a3}=4.8× 10^{-13}$)脱水聚合得到一分子${H_{4}P_{2}O_{7}}$($K_{a3}=2.0× 10^{-7}$),从${PO^{3-}_{4}}$、${HP_{2}O^{3-}_{7}}$的结构角度分析$K_{a3}$差异的原因
请回答:
(1)关于ⅤA族元素原子结构的描述,下列说法正确的是
AD
。A. 基态P原子3p轨道上的电子自旋方向相同
B. ${As^{3+}}$的最外层电子数为18
C. ${P^{3+}}$的半径小于${P^{5+}}$的半径
D. 电子排布为${[Ne] 3s^1 3p^4}$的P原子处于激发态
(2)某化合物的晶胞如图。

①化学式是
Ca₃PCl₃
。②将0.01 mol该化合物加入到含少量石蕊的10 mL ${H_{2}O}$中,实验现象是
溶液变蓝,产生气泡,溶液出现浑浊
(从酸碱性和溶解性角度推测)。(3)两分子${H_{3}PO_{4}}$($K_{a3}=4.8× 10^{-13}$)脱水聚合得到一分子${H_{4}P_{2}O_{7}}$($K_{a3}=2.0× 10^{-7}$),从${PO^{3-}_{4}}$、${HP_{2}O^{3-}_{7}}$的结构角度分析$K_{a3}$差异的原因
PO₄³⁻离子半径小,负电荷密度高,吸附H⁺能力强,而HP₂O₇⁴⁻离子半径大,负电荷密度低,吸附H⁺能力弱
。
答案:
1.(7分)
(1)AD
(2)①Ca₃PCl₃ ②溶液变蓝,产生气泡,溶液出现浑浊
(3)PO₄³⁻离子半径小,负电荷密度高,吸附H⁺能力强,而HP₂O₇⁴⁻离子半径大,负电荷密度低,吸附H⁺能力弱
(1)AD
(2)①Ca₃PCl₃ ②溶液变蓝,产生气泡,溶液出现浑浊
(3)PO₄³⁻离子半径小,负电荷密度高,吸附H⁺能力强,而HP₂O₇⁴⁻离子半径大,负电荷密度低,吸附H⁺能力弱
2. (2024·1月浙江卷,10分)氮和氧是构建化合物的常见元素。
已知: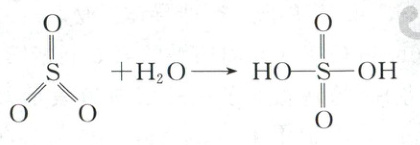
请回答:
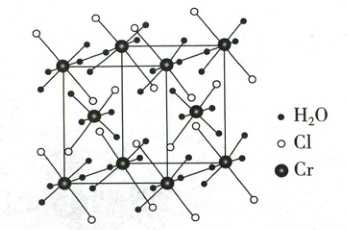
(1)某化合物的晶胞如图,其化学式是
(2)下列说法正确的是
A. 电负性:${B > N > O}$
B. 离子半径:${P^{3-} < S^{2-} < Cl^{-}}$
C. 第一电离能:${Ge < Se < As}$
D. 基态${Cr^{2+}}$的简化电子排布式${[Ar] 3d^4}$
(3)①${H_{2}N - NH_{2} + H^{+} \longrightarrow H_{2}N - NH^{+}_{3}}$,其中${-NH_{2}}$的N原子杂化方式为
②将${HNO_{3}}$与${SO_{3}}$按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是${NO^{+}_{2}}$。比较氧化性强弱:${NO^{+}_{2}}$
已知:

请回答:
(1)某化合物的晶胞如图,其化学式是
Cr(H₂O)₄Cl₂或CrCl₂·4H₂O
,晶体类型是分子晶体或分子
。(2)下列说法正确的是
CD
。A. 电负性:${B > N > O}$
B. 离子半径:${P^{3-} < S^{2-} < Cl^{-}}$
C. 第一电离能:${Ge < Se < As}$
D. 基态${Cr^{2+}}$的简化电子排布式${[Ar] 3d^4}$
(3)①${H_{2}N - NH_{2} + H^{+} \longrightarrow H_{2}N - NH^{+}_{3}}$,其中${-NH_{2}}$的N原子杂化方式为
sp³
;比较键角$\angle {HNH}$:${H_{2}N - NH_{2}}$中的${-NH_{2}}$<
(填“>”“<”或“=”)${H_{2}N - NH^{+}_{3}}$中${-NH^{+}_{3}}$,请说明理由—NH₂中N有孤电子对,对成键电子对的斥力大,键角小
。②将${HNO_{3}}$与${SO_{3}}$按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是${NO^{+}_{2}}$。比较氧化性强弱:${NO^{+}_{2}}$
>
(填“>”“<”或“=”)${HNO_{3}}$;写出A中阴离子的结构式。
答案:
2.(10分)
(1)Cr(H₂O)₄Cl₂或CrCl₂·4H₂O 分子晶体或分子
(2)CD
(3)①sp³ < —NH₂中N有孤电子对,对成键电子对的斥力大,键角小 ②>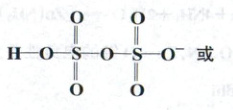
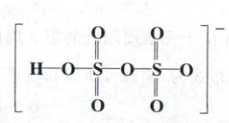
2.(10分)
(1)Cr(H₂O)₄Cl₂或CrCl₂·4H₂O 分子晶体或分子
(2)CD
(3)①sp³ < —NH₂中N有孤电子对,对成键电子对的斥力大,键角小 ②>
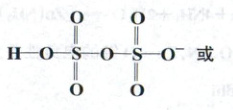

3. (2023·北京卷,10分)硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根(${S_{2}O^{2-}_{3}}$)可看作是${SO^{2-}_{4}}$中的一个O原子被S原子取代的产物。
(1)基态S原子价层电子排布式是
(2)比较S原子和O原子的第一电离能大小,从原子结构的角度说明理由:
(3)${S_{2}O^{2-}_{3}}$的空间结构是
(4)同位素示踪实验可证实${S_{2}O^{2-}_{3}}$中两个S原子的化学环境不同,实验过程为${SO^{2-}_{3} \xrightarrow[ⅰ]{S} S_{2}O^{2-}_{3} \xrightarrow[ⅱ]{Ag^{+}} Ag_{2}S + SO^{2-}_{4}}$。过程ⅱ中,${S_{2}O^{2-}_{3}}$断裂的只有硫硫键,若过程ⅰ所用试剂是${Na_{2}^{32}SO_{3}}$和${^{35}S}$,过程ⅱ含硫产物是
(5)${MgS_{2}O_{3} · 6H_{2}O}$的晶胞形状为长方体,边长分别为$a\ nm$、$b\ nm$、$c\ nm$,结构如图所示。
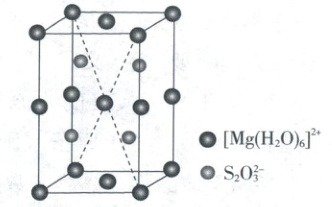
晶胞中的${[Mg(H_{2}O)_{6}]^{2+}}$个数为
(6)浸金时,${S_{2}O^{2-}_{3}}$作为配体可提供孤电子对与${Au^{+}}$形成${[Au(S_{2}O_{3})_{2}]^{3-}}$。分别判断${S_{2}O^{2-}_{3}}$中的中心S原子和端基S原子能否做配位原子并说明理由:
(1)基态S原子价层电子排布式是
3s²3p⁴
。(2)比较S原子和O原子的第一电离能大小,从原子结构的角度说明理由:
第一电离能O>S。O和S为同主族元素,电子层数S>O,原子半径S>O,原子核对最外层电子的吸引作用O>S
。(3)${S_{2}O^{2-}_{3}}$的空间结构是
四面体形
。(4)同位素示踪实验可证实${S_{2}O^{2-}_{3}}$中两个S原子的化学环境不同,实验过程为${SO^{2-}_{3} \xrightarrow[ⅰ]{S} S_{2}O^{2-}_{3} \xrightarrow[ⅱ]{Ag^{+}} Ag_{2}S + SO^{2-}_{4}}$。过程ⅱ中,${S_{2}O^{2-}_{3}}$断裂的只有硫硫键,若过程ⅰ所用试剂是${Na_{2}^{32}SO_{3}}$和${^{35}S}$,过程ⅱ含硫产物是
Ag₂³⁵S、³²SO₄²⁻
。(5)${MgS_{2}O_{3} · 6H_{2}O}$的晶胞形状为长方体,边长分别为$a\ nm$、$b\ nm$、$c\ nm$,结构如图所示。

晶胞中的${[Mg(H_{2}O)_{6}]^{2+}}$个数为
4
。已知${MgS_{2}O_{3} · 6H_{2}O}$的摩尔质量是$M\ g/mol$,阿伏加德罗常数为$N_{A}$,该晶体的密度为$\frac{4 × M}{6.02 × 10^{23} × a b c × 10^{-21}}$
$g/cm^3$。($1\ nm=10^{-7}\ cm$)(6)浸金时,${S_{2}O^{2-}_{3}}$作为配体可提供孤电子对与${Au^{+}}$形成${[Au(S_{2}O_{3})_{2}]^{3-}}$。分别判断${S_{2}O^{2-}_{3}}$中的中心S原子和端基S原子能否做配位原子并说明理由:
端基S原子有孤电子对可以做配位原子,而中心S原子无孤对电子不可以做配位原子
。
答案:
3.(10分)
(1)3s²3p⁴
(2)第一电离能O>S。O和S为同主族元素,电子层数S>O,原子半径S>O,原子核对最外层电子的吸引作用O>S
(3)四面体形
(4)Ag₂³⁵S、³²SO₄²⁻
(5)$\frac{4 × M}{6.02 × 10^{23} × a b c × 10^{-21}}$
(6)端基S原子有孤电子对可以做配位原子,而中心S原子无孤对电子不可以做配位原子
[解析]物质结构综合
(1)S是第三周期VIA族元素,基态S原子价层电子排布式为3s²3p⁴。
(2)S和O为同主族元素,O原子核外有2个电子层,S原子核外有3个电子层,O原子半径小,原子核对最外层电子的吸引力大,不易失去1个电子,即O的第一电离能大于S的第一电离能。
(3)SO₄²⁻的中心原子S的价层电子对数为4,无孤电子对,空间构型为四面体形,S₂O₃²⁻可看作是SO₄²⁻中1个O原子被S原子取代,则S₂O₃²⁻的空间构型为四面体形。
(4)过程ⅱ中S₂O₃²⁻断裂的只有硫硫键,根据反应机理可知,整个过程中SO₄²⁻最终转化为SO₄²⁻,S最终转化为Ag₂S。若过程ⅰ所用的试剂为Na₂³²SO₃和³⁵S,过程ⅱ的含硫产物是³²SO₄²⁻和Ag₂³⁵S。
(5)由晶胞结构可知,1个晶胞中含有8×$\frac{1}{8}$ + 4×$\frac{1}{4}$ + 2×$\frac{1}{2}$ + 1 = 4个[Mg(H₂O)₆]²⁺,含有4个S₂O₃²⁻;该晶体的密度ρ = $\frac{NM}{N_A V}$ = $\frac{4 × M}{6.02 × 10^{23} × a b c × 10^{-21}}$g/cm³。
(1)3s²3p⁴
(2)第一电离能O>S。O和S为同主族元素,电子层数S>O,原子半径S>O,原子核对最外层电子的吸引作用O>S
(3)四面体形
(4)Ag₂³⁵S、³²SO₄²⁻
(5)$\frac{4 × M}{6.02 × 10^{23} × a b c × 10^{-21}}$
(6)端基S原子有孤电子对可以做配位原子,而中心S原子无孤对电子不可以做配位原子
[解析]物质结构综合
(1)S是第三周期VIA族元素,基态S原子价层电子排布式为3s²3p⁴。
(2)S和O为同主族元素,O原子核外有2个电子层,S原子核外有3个电子层,O原子半径小,原子核对最外层电子的吸引力大,不易失去1个电子,即O的第一电离能大于S的第一电离能。
(3)SO₄²⁻的中心原子S的价层电子对数为4,无孤电子对,空间构型为四面体形,S₂O₃²⁻可看作是SO₄²⁻中1个O原子被S原子取代,则S₂O₃²⁻的空间构型为四面体形。
(4)过程ⅱ中S₂O₃²⁻断裂的只有硫硫键,根据反应机理可知,整个过程中SO₄²⁻最终转化为SO₄²⁻,S最终转化为Ag₂S。若过程ⅰ所用的试剂为Na₂³²SO₃和³⁵S,过程ⅱ的含硫产物是³²SO₄²⁻和Ag₂³⁵S。
(5)由晶胞结构可知,1个晶胞中含有8×$\frac{1}{8}$ + 4×$\frac{1}{4}$ + 2×$\frac{1}{2}$ + 1 = 4个[Mg(H₂O)₆]²⁺,含有4个S₂O₃²⁻;该晶体的密度ρ = $\frac{NM}{N_A V}$ = $\frac{4 × M}{6.02 × 10^{23} × a b c × 10^{-21}}$g/cm³。
查看更多完整答案,请扫码查看


