2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第57页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
10. (2023·全国乙卷,6分)室温钠-硫电池被认为是一种成本低、比能量高的能源存储系统。一种室温钠-硫电池的结构如图所示。将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末的炭化纤维素纸作为另一电极。工作时,在硫电极发生反应:${\frac{1}{2}S_{8} + e^{-}\to \frac{1}{2}S^{2-}_{8}}$,${\frac{1}{2}S^{2-}_{8} + e^{-}\to S^{2-}_{4}}$,${2Na^{+} + \frac{x}{4}S^{2-}_{4} + 2(1 - \frac{x}{4})e^{-}\to Na_{2}S_{x}}$
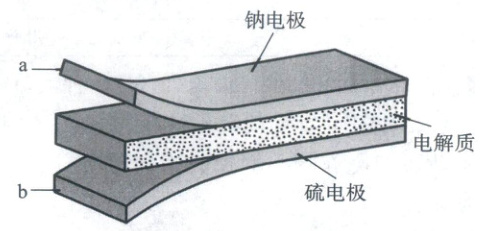
下列叙述错误的是 (
A.充电时${Na^{+}}$从钠电极向硫电极迁移
B.放电时外电路电子流动的方向是$a\tob$
C.放电时正极反应为:${2Na^{+} + \frac{x}{8}S_{8} + 2e^{-}\to Na_{2}S_{x}}$
D.炭化纤维素纸的作用是增强硫电极导电性能

下列叙述错误的是 (
A
)A.充电时${Na^{+}}$从钠电极向硫电极迁移
B.放电时外电路电子流动的方向是$a\tob$
C.放电时正极反应为:${2Na^{+} + \frac{x}{8}S_{8} + 2e^{-}\to Na_{2}S_{x}}$
D.炭化纤维素纸的作用是增强硫电极导电性能
答案:
10.A 原电池原理
【电池分析】由题可知:钠−硫电池中,钠单质为活泼金属,易失电子作负极,充电时作阴极;硫单质为非金属,易得电子作正极,充电时作阳极。
充电时阳离子向阴极移动,即Na⁺向钠电极移动,在钠电极上得电子变为钠单质,A错误;放电时该装置是原电池,电子从负极流出,经外电路流向正极,B正确;放电时正极发生还原反应,从得失电子和电荷守恒角度可知正极反应,C正确;炭化纤维素纸主要成分是碳,由题意可知,涂有硫黄粉末的炭化纤维素纸的作用是增强电极导电性,D正确。
真题互鉴
2017年全国Ⅲ卷11题为锂硫电池,与本题情境稍有区别,但是两题均以硫的变价问题对电化学知识进行考查。
【电池分析】由题可知:钠−硫电池中,钠单质为活泼金属,易失电子作负极,充电时作阴极;硫单质为非金属,易得电子作正极,充电时作阳极。
充电时阳离子向阴极移动,即Na⁺向钠电极移动,在钠电极上得电子变为钠单质,A错误;放电时该装置是原电池,电子从负极流出,经外电路流向正极,B正确;放电时正极发生还原反应,从得失电子和电荷守恒角度可知正极反应,C正确;炭化纤维素纸主要成分是碳,由题意可知,涂有硫黄粉末的炭化纤维素纸的作用是增强电极导电性,D正确。
真题互鉴
2017年全国Ⅲ卷11题为锂硫电池,与本题情境稍有区别,但是两题均以硫的变价问题对电化学知识进行考查。
1. (2025·1月浙江卷,3分)一种可充放电${Li - O_{2}}$电池的结构示意图如图所示。该电池放电时,产物为${Li_{2}O}$和${Li_{2}O_{2}}$,随温度升高$Q$(消耗$1\ mol\ {O_{2}}$转移的电子数)增大。
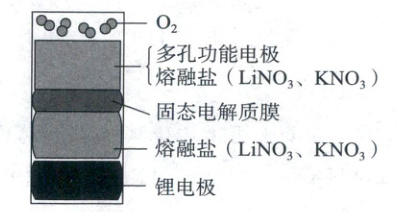
下列说法不正确的是 (
A.熔融盐中${LiNO_{3}}$的物质的量分数影响充放电速率
B.充放电时,${Li^{+}}$优先于${K^{+}}$通过固态电解质膜
C.放电时,随温度升高$Q$增大,是因为正极区${O^{2-}}$转化为${O^{2-}_{2}}$
D.充电时,锂电极接电源负极

下列说法不正确的是 (
C
)A.熔融盐中${LiNO_{3}}$的物质的量分数影响充放电速率
B.充放电时,${Li^{+}}$优先于${K^{+}}$通过固态电解质膜
C.放电时,随温度升高$Q$增大,是因为正极区${O^{2-}}$转化为${O^{2-}_{2}}$
D.充电时,锂电极接电源负极
答案:
1.C 原电池与电解池工作原理

电池总反应方程式为$2Li+O₂\overset{放电}{\underset{充电}{\rightleftharpoons}}Li₂O₂$与$4Li+O₂\overset{放电}{\underset{充电}{\rightleftharpoons}}2Li₂O,$有Li⁺的迁移,因此熔融盐中LiNO₃的物质的量分数影响充放电速率,A正确;因Li⁺的半径比K⁺小,再结合产物的成分,可知Li⁺优先通过固态电解质膜的孔隙,B正确;由题给信息,Q是消耗1molO₂转移的电子数,放电时,正极O₂得到电子,O₂得到电子越多化合价降低越多,因此随温度升高Q增大,正极区O₂²⁻转化为O²⁻,C错误;充电时,锂电极为阴极,与外接电源负极相连,D正确。
1.C 原电池与电解池工作原理

电池总反应方程式为$2Li+O₂\overset{放电}{\underset{充电}{\rightleftharpoons}}Li₂O₂$与$4Li+O₂\overset{放电}{\underset{充电}{\rightleftharpoons}}2Li₂O,$有Li⁺的迁移,因此熔融盐中LiNO₃的物质的量分数影响充放电速率,A正确;因Li⁺的半径比K⁺小,再结合产物的成分,可知Li⁺优先通过固态电解质膜的孔隙,B正确;由题给信息,Q是消耗1molO₂转移的电子数,放电时,正极O₂得到电子,O₂得到电子越多化合价降低越多,因此随温度升高Q增大,正极区O₂²⁻转化为O²⁻,C错误;充电时,锂电极为阴极,与外接电源负极相连,D正确。
2. (2025·广东卷,3分)一种高容量水系电池示意图如图。已知:放电时,电极Ⅱ上${MnO_{2}}$减少;电极材料每转移$1\ mol$电子,对应的理论容量为$26.8\ A·h$。下列说法错误的是 (
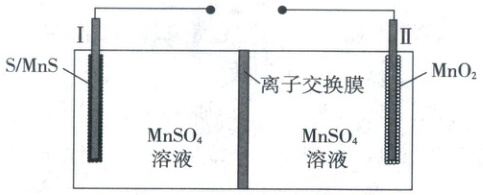
A.充电时Ⅱ为阳极
B.放电时Ⅱ极室中溶液的${pH}$降低
C.放电时负极反应为${MnS - 2e^{-}\xlongequal{}S + Mn^{2+}}$
D.充电时$16\ g\ {S}$能提供的理论容量为$26.8\ A·h$
D
)
A.充电时Ⅱ为阳极
B.放电时Ⅱ极室中溶液的${pH}$降低
C.放电时负极反应为${MnS - 2e^{-}\xlongequal{}S + Mn^{2+}}$
D.充电时$16\ g\ {S}$能提供的理论容量为$26.8\ A·h$
答案:
2.D 电化学原理

充电时,电池正极与电源正极相连,作阳极,A正确;由放电时II极室的电极反应可知放电时II极室中溶液的pH升高,B错误;16gS的物质的量为0.5mol,充电时,理论上16gS完全反应能转移1mole⁻,能提供的理论容量为26.8A·h,D正确。
2.D 电化学原理

充电时,电池正极与电源正极相连,作阳极,A正确;由放电时II极室的电极反应可知放电时II极室中溶液的pH升高,B错误;16gS的物质的量为0.5mol,充电时,理论上16gS完全反应能转移1mole⁻,能提供的理论容量为26.8A·h,D正确。
3. (2025·山东卷,4分,不定项)全铁液流电池工作原理如图所示,两电极分别为石墨电极和负载铁的石墨电极。下列说法正确的是 (
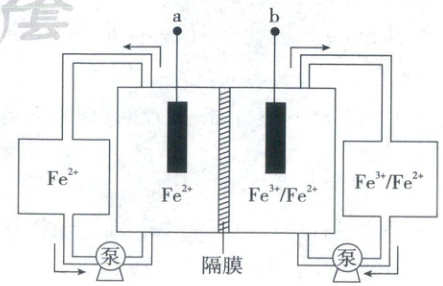
A.隔膜为阳离子交换膜
B.放电时,a极为负极
C.充电时,隔膜两侧溶液${Fe^{2+}}$浓度均减小
D.理论上,${Fe^{3+}}$每减少$1\ mol$,${Fe^{2+}}$总量相应增加$2\ mol$
BC
)
A.隔膜为阳离子交换膜
B.放电时,a极为负极
C.充电时,隔膜两侧溶液${Fe^{2+}}$浓度均减小
D.理论上,${Fe^{3+}}$每减少$1\ mol$,${Fe^{2+}}$总量相应增加$2\ mol$
答案:
3.BC 电化学

图示中Fe²⁺和Fe³⁺/Fe²⁺在两极循环,故隔膜应为阴离子交换膜,A错误;由【电池分析】可知,B正确;由电极反应式可知,充电时两侧溶液中Fe²⁺浓度均减小,C正确;正极Fe³⁺~e⁻~Fe²⁺,负极e⁻~0.5Fe²⁺,故Fe³⁺每减少1mol,Fe²⁺总量增加1.5mol,D错误。
3.BC 电化学

图示中Fe²⁺和Fe³⁺/Fe²⁺在两极循环,故隔膜应为阴离子交换膜,A错误;由【电池分析】可知,B正确;由电极反应式可知,充电时两侧溶液中Fe²⁺浓度均减小,C正确;正极Fe³⁺~e⁻~Fe²⁺,负极e⁻~0.5Fe²⁺,故Fe³⁺每减少1mol,Fe²⁺总量增加1.5mol,D错误。
查看更多完整答案,请扫码查看


