2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第60页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
1.【生产环保】(2025·河南卷,3分)一种液流电解池在工作时可以实现海水淡化,并以${LiCl}$形式回收含锂废弃物中的锂元素,其工作原理如图所示。
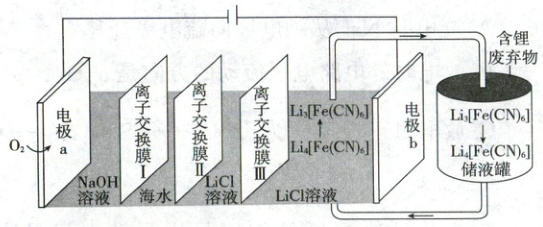
下列说法正确的是 (
A.Ⅱ为阳离子交换膜
B.电极${a}$附近溶液的${pH}$减小
C.电极${b}$上发生的电极反应式为${[Fe(CN)_{6}]^{4-} + e^{-}\xlongequal{}[Fe(CN)_{6}]^{3-}}$
D.若海水用${NaCl}$溶液模拟,则每脱除$58.5\ {g}$${NaCl}$,理论上可回收$1\ {mol}$${LiCl}$

下列说法正确的是 (
D
)A.Ⅱ为阳离子交换膜
B.电极${a}$附近溶液的${pH}$减小
C.电极${b}$上发生的电极反应式为${[Fe(CN)_{6}]^{4-} + e^{-}\xlongequal{}[Fe(CN)_{6}]^{3-}}$
D.若海水用${NaCl}$溶液模拟,则每脱除$58.5\ {g}$${NaCl}$,理论上可回收$1\ {mol}$${LiCl}$
答案:
1.D 电解池 电解池从左至右流出物质主要是氢氧化钠溶液、淡水、氯化锂溶液、$Li_3[Fe(CN)_6]$溶液。离子交换膜类型分别是阳、阴、阳,A错误;电极a上氧气得电子生成氢氧根离子,使溶液pH升高,B错误;电极b为阳极,发生氧化反应,失电子而不是得电子,C错误;$58.5\ g\ NaCl$为$1\ mol$,理论上可回收$LiCl$也是$1\ mol$,D正确。
2.(2025·河北卷,3分)科研工作者设计了一种用于废弃电极材料${Li_{x}CoO_{2}}(x<1)$再锂化的电化学装置,其示意图如图所示:
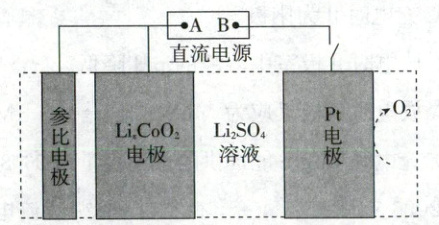
已知:参比电极的作用是确定${Li_{x}CoO_{2}}$再锂化为${LiCoO_{2}}$的最优条件,不干扰电极反应。下列说法正确的是 (
A.${Li_{x}CoO_{2}}$电极上发生的反应:${Li_{x}CoO_{2} + }$$x{e^{-} + xLi^{+}\xlongequal{}LiCoO_{2}}$
B.产生标准状况下$5.6\ {L}$${O_{2}}$时,理论上可转化$\dfrac{1}{1-x}\ {mol}$的${Li_{x}CoO_{2}}$
C.再锂化过程中,${SO^{2-}_{4}}$向${Li_{x}CoO_{2}}$电极迁移
D.电解过程中,阳极附近溶液${pH}$升高

已知:参比电极的作用是确定${Li_{x}CoO_{2}}$再锂化为${LiCoO_{2}}$的最优条件,不干扰电极反应。下列说法正确的是 (
B
)A.${Li_{x}CoO_{2}}$电极上发生的反应:${Li_{x}CoO_{2} + }$$x{e^{-} + xLi^{+}\xlongequal{}LiCoO_{2}}$
B.产生标准状况下$5.6\ {L}$${O_{2}}$时,理论上可转化$\dfrac{1}{1-x}\ {mol}$的${Li_{x}CoO_{2}}$
C.再锂化过程中,${SO^{2-}_{4}}$向${Li_{x}CoO_{2}}$电极迁移
D.电解过程中,阳极附近溶液${pH}$升高
答案:
2.B 电化学 该装置为电解池,$Pt$电极生成氧气,故电极反应式为$2H_2O-4e^-\xlongequal{}O_2\uparrow+4H^+$,因此$Pt$为阳极,B为正极,$Li_xCoO_2$为阴极,A为负极。阴极发生还原反应,电极反应式为$Li_xCoO_2+(1-x)e^-+(1-x)Li^+\xlongequal{}LiCoO_2$,A错误;当阳极生成$0.25\ mol\ O_2$时,根据电极反应式可知,失去$1\ mol$电子,再结合阴极电极反应式可求得转化的$n(Li_xCoO_2)=\frac{1}{1-x}mol$,B正确;再锂化过程就是电解过程,硫酸根离子移向阳极($Pt$电极),C错误;电解过程中,阳极反应生成$H^+$,因此阳极附近溶液pH降低,D错误。
3.【创新试题】(2025·湖北卷,3分)某电化学制冷系统的装置如图所示。${[Fe(H_{2}O)_{6}]^{3+}}$和${[Fe(H_{2}O)_{6}]^{2+}}$在电极上发生相互转化,伴随着热量的吸收或释放,经由泵推动电解质溶液的循环流动(${①→②→③→④→①}$)实现制冷。装置只通过热交换区域Ⅰ和Ⅱ与环境进行传热,其他区域绝热。下列描述错误的是 (
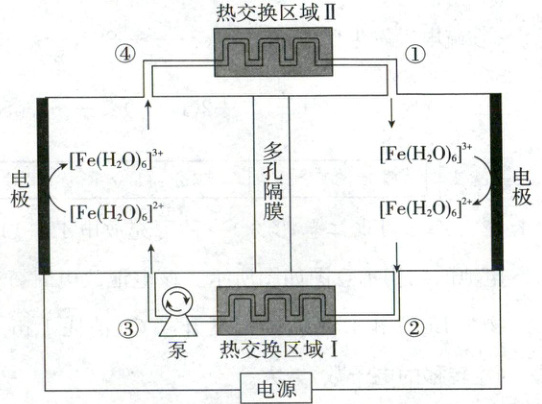
A.阴极反应为${[Fe(H_{2}O)_{6}]^{3+} + e^{-}\xlongequal{}}$${[Fe(H_{2}O)_{6}]^{2+}}$
B.已知${②}$处的电解液温度比${①}$处的低,可推断${[Fe(H_{2}O)_{6}]^{2+}}$比${[Fe(H_{2}O)_{6}]^{3+}}$稳定
C.多孔隔膜可以阻止阴极区和阳极区间的热交换
D.已知电子转移过程非常快,物质结构来不及改变。热效应主要来自于电子转移后${[Fe(H_{2}O)_{6}]^{2+}}$和${[Fe(H_{2}O)_{6}]^{3+}}$离子结构的改变
B
)
A.阴极反应为${[Fe(H_{2}O)_{6}]^{3+} + e^{-}\xlongequal{}}$${[Fe(H_{2}O)_{6}]^{2+}}$
B.已知${②}$处的电解液温度比${①}$处的低,可推断${[Fe(H_{2}O)_{6}]^{2+}}$比${[Fe(H_{2}O)_{6}]^{3+}}$稳定
C.多孔隔膜可以阻止阴极区和阳极区间的热交换
D.已知电子转移过程非常快,物质结构来不及改变。热效应主要来自于电子转移后${[Fe(H_{2}O)_{6}]^{2+}}$和${[Fe(H_{2}O)_{6}]^{3+}}$离子结构的改变
答案:
3.B 电化学
【电池分析】由物质的转化可知,左端电极为阳极,右端电极为阴极。
物质在阴极上得电子,A正确;②处电解液温度低说明阴极上的转化过程为吸热反应,$[Fe(H_2O)_6]^{3+}$的能量相对更低,更稳定,B错误;③$\longrightarrow$④为放热,①$\longrightarrow$②为吸热,为保障制冷效果,多孔隔膜应起到阻止热交换的作用,C正确;根据题干信息及电极反应,可知热效应主要与$[Fe(H_2O)_6]^{2+}$和$[Fe(H_2O)_6]^{3+}$的离子结构变化有关,D正确。
【电池分析】由物质的转化可知,左端电极为阳极,右端电极为阴极。
物质在阴极上得电子,A正确;②处电解液温度低说明阴极上的转化过程为吸热反应,$[Fe(H_2O)_6]^{3+}$的能量相对更低,更稳定,B错误;③$\longrightarrow$④为放热,①$\longrightarrow$②为吸热,为保障制冷效果,多孔隔膜应起到阻止热交换的作用,C正确;根据题干信息及电极反应,可知热效应主要与$[Fe(H_2O)_6]^{2+}$和$[Fe(H_2O)_6]^{3+}$的离子结构变化有关,D正确。
4.(2025·云南卷,3分)一种用双极膜电渗析法卤水除硼的装置如图所示,双极膜中${H_{2}O}$解离的${H^{+}}$和${OH^{-}}$在电场作用下向两极迁移。除硼原理:${[B(OH)_{4}]^{-} + H^{+}\xlongequal{}B(OH)_{3} + H_{2}O}$。下列说法错误的是 (
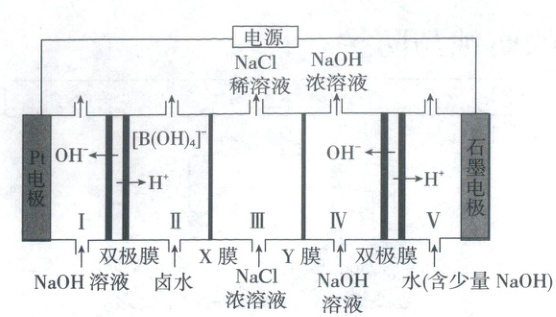
A.${Pt}$电极反应:${4OH^{-} - 4e^{-}\xlongequal{}O_{2}↑ + 2H_{2}O}$
B.外加电场可促进双极膜中水的电离
C.Ⅲ室中,${X}$膜、${Y}$膜分别为阳离子交换膜和阴离子交换膜
D.Ⅳ室每生成$1\ {mol}$${NaOH}$,同时Ⅱ室最多生成$1\ {mol}$${B(OH)_{3}}$
C
)
A.${Pt}$电极反应:${4OH^{-} - 4e^{-}\xlongequal{}O_{2}↑ + 2H_{2}O}$
B.外加电场可促进双极膜中水的电离
C.Ⅲ室中,${X}$膜、${Y}$膜分别为阳离子交换膜和阴离子交换膜
D.Ⅳ室每生成$1\ {mol}$${NaOH}$,同时Ⅱ室最多生成$1\ {mol}$${B(OH)_{3}}$
答案:
4.C 电化学
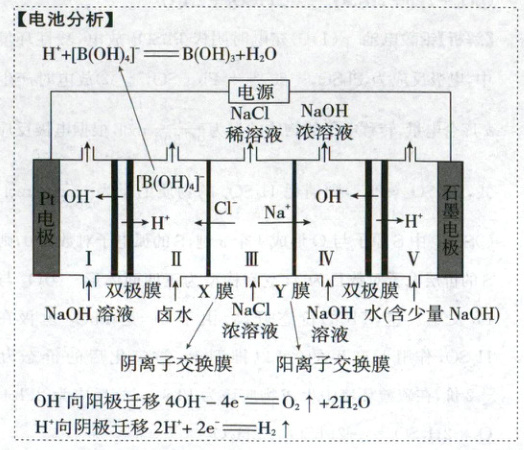
$Pt$电极为阳极,电极反应式为$4OH^--4e^-\xlongequal{}O_2\uparrow+2H_2O$,A正确;双极膜中水解离所得$H^+$及$OH^-$在外加电场作用下可分别向两极移动,进而促进水的电离平衡正向移动,促进水的电离,B正确;通过Ⅲ室$NaCl$浓度减小,可得其中$Na^+$通过离子交换膜Y向右侧迁移,而$Cl^-$通过离子交换膜X向左侧迁移,所以X膜、Y膜分别为阴离子交换膜和阳离子交换膜,C错误;Ⅳ室每生成$1\ mol\ NaOH$,即有$1\ mol\ Na^+$通过离子交换膜Y向Ⅳ室迁移,同时有$1\ mol\ OH^-$通过双极膜向Ⅳ室迁移,可知电路中转移$1\ mol$电子,所以有$1\ mol\ H^+$通过双极膜向Ⅱ室迁移,结合反应方程式,可得Ⅱ室最多生成$1\ mol\ B(OH)_3$,D正确。
4.C 电化学

$Pt$电极为阳极,电极反应式为$4OH^--4e^-\xlongequal{}O_2\uparrow+2H_2O$,A正确;双极膜中水解离所得$H^+$及$OH^-$在外加电场作用下可分别向两极移动,进而促进水的电离平衡正向移动,促进水的电离,B正确;通过Ⅲ室$NaCl$浓度减小,可得其中$Na^+$通过离子交换膜Y向右侧迁移,而$Cl^-$通过离子交换膜X向左侧迁移,所以X膜、Y膜分别为阴离子交换膜和阳离子交换膜,C错误;Ⅳ室每生成$1\ mol\ NaOH$,即有$1\ mol\ Na^+$通过离子交换膜Y向Ⅳ室迁移,同时有$1\ mol\ OH^-$通过双极膜向Ⅳ室迁移,可知电路中转移$1\ mol$电子,所以有$1\ mol\ H^+$通过双极膜向Ⅱ室迁移,结合反应方程式,可得Ⅱ室最多生成$1\ mol\ B(OH)_3$,D正确。
查看更多完整答案,请扫码查看


