2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第86页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
7. (2024·山东卷,2分)常温下${Ag}$(Ⅰ)-${CH_{3}COOH}$水溶液体系中存在反应:${Ag^{+} + CH_{3}COO^{-}⇌ CH_{3}COOAg(aq)}$,平衡常数为$K$。已知初始浓度$c_{0}({Ag^{+}})=c_{0}({CH_{3}COOH})=0.08\ mol/L$,所有含碳物种的摩尔分数与pH变化关系如图所示(忽略溶液体积变化)。
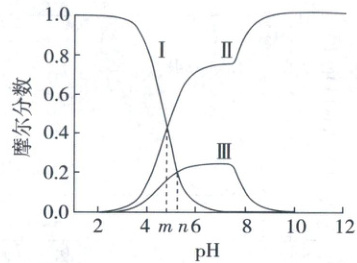
下列说法正确的是 (
A.线Ⅱ表示${CH_{3}COOH}$的变化情况
B.${CH_{3}COOH}$的电离平衡常数$K_{a}=10^{-n}$
C.${pH}=n$时,$c({Ag^{+}})=\dfrac{10^{m-n}}{K}\ mol/L$
D.${pH}=10$时,$c({Ag^{+}})+c({CH_{3}COOAg})=0.08\ mol/L$

下列说法正确的是 (
C
)A.线Ⅱ表示${CH_{3}COOH}$的变化情况
B.${CH_{3}COOH}$的电离平衡常数$K_{a}=10^{-n}$
C.${pH}=n$时,$c({Ag^{+}})=\dfrac{10^{m-n}}{K}\ mol/L$
D.${pH}=10$时,$c({Ag^{+}})+c({CH_{3}COOAg})=0.08\ mol/L$
答案:
7.C 溶液中的离子反应与平衡
【图像分析】
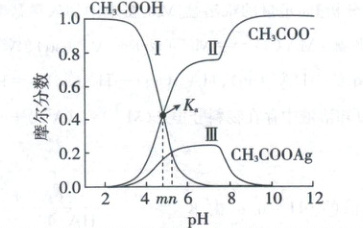
线Ⅰ表示$CH_3COOH$的变化情况,线Ⅱ表示$CH_3COO^-$的变化情况,线Ⅲ表示$CH_3COOAg$的变化情况,A项错误;由【图像分析】可知,线Ⅰ与线Ⅱ交点处可解得$K_a=\frac{c(CH_3COO^-)· c(H^+)}{c(CH_3COOH)}=c(H^+)=10^{-m}$,B项错误;pH=n时,$c(CH_3COOH)=c(CH_3COOAg)$,$K=\frac{c(CH_3COOAg)}{c(CH_3COO^-)· c(Ag^+)}=\frac{10^{-n}}{c(CH_3COO^-)}$,又$\frac{c(CH_3COO^-)·10^{-n}}{c(CH_3COOH)}=10^{-m}$,可得$c(CH_3COO^-)=10^{-m}· c(CH_3COOH)$,代入可得$c(Ag^+)=\frac{10^{m - n}}{K} mol/L$,C项正确;pH=10时,$Ag^+$生成$AgOH$,$CH_3COOAg$浓度降低,根据物料守恒,$c(Ag^+)+c(CH_3COOAg)<0.08 mol/L$,D项错误。
7.C 溶液中的离子反应与平衡
【图像分析】

线Ⅰ表示$CH_3COOH$的变化情况,线Ⅱ表示$CH_3COO^-$的变化情况,线Ⅲ表示$CH_3COOAg$的变化情况,A项错误;由【图像分析】可知,线Ⅰ与线Ⅱ交点处可解得$K_a=\frac{c(CH_3COO^-)· c(H^+)}{c(CH_3COOH)}=c(H^+)=10^{-m}$,B项错误;pH=n时,$c(CH_3COOH)=c(CH_3COOAg)$,$K=\frac{c(CH_3COOAg)}{c(CH_3COO^-)· c(Ag^+)}=\frac{10^{-n}}{c(CH_3COO^-)}$,又$\frac{c(CH_3COO^-)·10^{-n}}{c(CH_3COOH)}=10^{-m}$,可得$c(CH_3COO^-)=10^{-m}· c(CH_3COOH)$,代入可得$c(Ag^+)=\frac{10^{m - n}}{K} mol/L$,C项正确;pH=10时,$Ag^+$生成$AgOH$,$CH_3COOAg$浓度降低,根据物料守恒,$c(Ag^+)+c(CH_3COOAg)<0.08 mol/L$,D项错误。
8. (2024·湖北卷,3分)${CO_{2}}$气氛下,${Pb(ClO_{4})_{2}}$溶液中含铅物种的分布如图。纵坐标($\delta$)为组分中铅占总铅的质量分数。
已知:$c_{0}({Pb^{2+}})=2.0× 10^{-5}\ mol/L$,$pK_{a1}({H_{2}CO_{3}})=6.4$、$pK_{a2}({H_{2}CO_{3}})=10.3$,$pK_{sp}({PbCO_{3}})=12.1$。下列说法错误的是 (
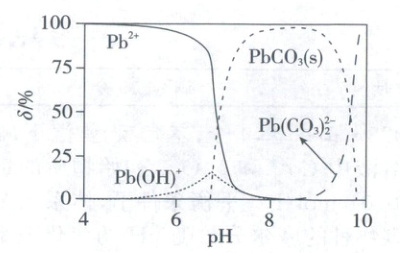
A.${pH}=6.5$时,溶液中$c({CO^{2-}_{3}})<c({Pb^{2+}})$
B.$\delta({Pb^{2+}})=\delta({PbCO_{3}})$时,$c({Pb^{2+}})<1.0× 10^{-5}\ mol/L$
C.${pH}=7$时,$2c({Pb^{2+}})+c[{Pb(OH)^{+}}]<2c({CO^{2-}_{3}})+c({HCO^{-}_{3}})+c({ClO^{-}_{4}})$
D.${pH}=8$时,溶液中加入少量${NaHCO_{3}(s)}$,${PbCO_{3}}$会溶解
已知:$c_{0}({Pb^{2+}})=2.0× 10^{-5}\ mol/L$,$pK_{a1}({H_{2}CO_{3}})=6.4$、$pK_{a2}({H_{2}CO_{3}})=10.3$,$pK_{sp}({PbCO_{3}})=12.1$。下列说法错误的是 (
D
)
A.${pH}=6.5$时,溶液中$c({CO^{2-}_{3}})<c({Pb^{2+}})$
B.$\delta({Pb^{2+}})=\delta({PbCO_{3}})$时,$c({Pb^{2+}})<1.0× 10^{-5}\ mol/L$
C.${pH}=7$时,$2c({Pb^{2+}})+c[{Pb(OH)^{+}}]<2c({CO^{2-}_{3}})+c({HCO^{-}_{3}})+c({ClO^{-}_{4}})$
D.${pH}=8$时,溶液中加入少量${NaHCO_{3}(s)}$,${PbCO_{3}}$会溶解
答案:
8.D 溶液中的离子平衡 当pH=6.5时,$Pb^{2+}$质量分数约为75%,$c(Pb^{2+})=75\%×2×10^{-5} mol/L=1.5×10^{-5} mol/L$,$c(CO_3^{2-})\leq\frac{K_sp(PbCO_3)}{c(Pb^{2+})}=\frac{10^{-12.1}}{1.5×10^{-5}}=\frac{1}{1.5}×10^{-7.1}<c(Pb^{2+})$,A正确;根据图像可知$\delta(Pb^{2+})=\delta(PbCO_3)$时,两者质量分数均小于50%,因此$c(Pb^{2+})<50\%×2×10^{-5} mol/L=1×10^{-5} mol/L$,B正确;pH=7时,说明溶液中有碱性物质加入,未改变$n(ClO^-)$,而pH=7时已有$PbCO_3$沉淀析出,根据$Pb$元素与$Cl$元素的物料守恒,$2\{c(Pb^{2+})+c[Pb(OH)^+]+c[Pb(CO_3)_2^{2-}]\}<c(ClO^-)$,则$2c(Pb^{2+})+c[Pb(OH)^+]<2c(CO_3^{2-})+c(HCO_3^-)+c(ClO^-)$,C正确;饱和$NaHCO_3$溶液中$CO_3^{2-}$和$HCO_3^-$浓度可看作近似相等,由$K_a1· K_a2=\frac{c^2(H^+)· c(CO_3^{2-})}{c(H_2CO_3)}$可得,其pH约为8.35。pH=8时,加入少量$NaHCO_3(s)$,并不能降低溶液的pH,$PbCO_3$无法溶解,同时也不会明显提高溶液pH,$PbCO_3$无法转化为$Pb(CO_3)_2^{2-}$,D错误。
9. (2024·河北卷,3分)在水溶液中,${CN^{-}}$可与多种金属离子形成配离子。X、Y、Z三种金属离子分别与${CN^{-}}$形成配离子达平衡时,$\lg \dfrac{c(金属离子)}{c(配离子)}$与$-\lg c({CN^{-}})$的关系如图。
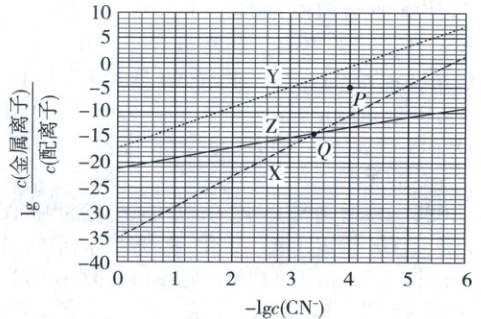
下列说法正确的是 (
A.99%的X、Y转化为配离子时,两溶液中${CN^{-}}$的平衡浓度$X>Y$
B.向Q点X、Z的混合液中加少量可溶性Y盐,达平衡时$\dfrac{c(X)}{c(X配离子)}>\dfrac{c(Z)}{c(Z配离子)}$
C.由Y和Z分别制备等物质的量的配离子时,消耗${CN^{-}}$的物质的量$Y<Z$
D.若相关离子的浓度关系如P点所示,Y配离子的解离速率小于生成速率

下列说法正确的是 (
B
)A.99%的X、Y转化为配离子时,两溶液中${CN^{-}}$的平衡浓度$X>Y$
B.向Q点X、Z的混合液中加少量可溶性Y盐,达平衡时$\dfrac{c(X)}{c(X配离子)}>\dfrac{c(Z)}{c(Z配离子)}$
C.由Y和Z分别制备等物质的量的配离子时,消耗${CN^{-}}$的物质的量$Y<Z$
D.若相关离子的浓度关系如P点所示,Y配离子的解离速率小于生成速率
答案:
9.B 溶液中离子反应与平衡
【图像分析】$CN^-$可与X、Y、Z三种金属离子形成配离子。溶液中的配离子存在平衡,以X为例:$X(CN)_m^{n - m} \rightleftharpoons X^{(n - m)+} + nCN^-$,该平衡常数为$K=\frac{c[X^{(n - m)+}]· c^n(CN^-)}{c[X(CN)_m^{n - m}]}$,两边求$-\lg$后可得$-\lg K = -\lg\frac{c[X^{(n - m)+}]}{c[X(CN)_m^{n - m}]}-n\lg c(CN^-)$。因此,图像中线的斜率就是n。通过图像可计算:Y的斜率为4,Z的斜率为2,X的斜率为6。可知X、Y、Z三种金属离子的配位数为6、4、2。
当99%的X、Y转化为配离子时,$\lg\frac{c(金属离子)}{c(配离子)}=\lg\frac{1}{99}\approx - 2$,由图像可知,两溶液中$CN^-$的平衡浓度:Y>X,A错误;Q点溶液中加入Y盐后,Y会与$CN^-$结合,导致$CN^-$浓度减小,$- \lg c(CN^-)$增大,$\lg\frac{c(X)}{c(X配离子)}>\lg\frac{c(Z)}{c(Z配离子)}$,$\frac{c(X)}{c(X配离子)}>\frac{c(Z)}{c(Z配离子)}$,B正确;由Y、Z分别制备等物质的量的配离子时,由于Y、Z两种离子的配位数为4、2,因此Y消耗的$CN^-$更多,C错误;P点溶液要达到Y的配位平衡,$Y(CN)_m^{n - m} \rightleftharpoons Y^{(n - m)+} + nCN^-$要正向移动,因此解离速率大于生成速率,D错误。
【图像分析】$CN^-$可与X、Y、Z三种金属离子形成配离子。溶液中的配离子存在平衡,以X为例:$X(CN)_m^{n - m} \rightleftharpoons X^{(n - m)+} + nCN^-$,该平衡常数为$K=\frac{c[X^{(n - m)+}]· c^n(CN^-)}{c[X(CN)_m^{n - m}]}$,两边求$-\lg$后可得$-\lg K = -\lg\frac{c[X^{(n - m)+}]}{c[X(CN)_m^{n - m}]}-n\lg c(CN^-)$。因此,图像中线的斜率就是n。通过图像可计算:Y的斜率为4,Z的斜率为2,X的斜率为6。可知X、Y、Z三种金属离子的配位数为6、4、2。
当99%的X、Y转化为配离子时,$\lg\frac{c(金属离子)}{c(配离子)}=\lg\frac{1}{99}\approx - 2$,由图像可知,两溶液中$CN^-$的平衡浓度:Y>X,A错误;Q点溶液中加入Y盐后,Y会与$CN^-$结合,导致$CN^-$浓度减小,$- \lg c(CN^-)$增大,$\lg\frac{c(X)}{c(X配离子)}>\lg\frac{c(Z)}{c(Z配离子)}$,$\frac{c(X)}{c(X配离子)}>\frac{c(Z)}{c(Z配离子)}$,B正确;由Y、Z分别制备等物质的量的配离子时,由于Y、Z两种离子的配位数为4、2,因此Y消耗的$CN^-$更多,C错误;P点溶液要达到Y的配位平衡,$Y(CN)_m^{n - m} \rightleftharpoons Y^{(n - m)+} + nCN^-$要正向移动,因此解离速率大于生成速率,D错误。
查看更多完整答案,请扫码查看


