2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第111页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
1.【模块融合】(2025·云南卷,14 分)从褐铁矿型金-银矿(含 Au、Ag、$\boldsymbol{{Fe_{2}O_{3}}}$、$\boldsymbol{{MnO_{2}}}$、$\boldsymbol{{CuO}}$、$\boldsymbol{{SiO_{2}}}$等)中提取 Au、Ag,并回收其他有价金属的一种工艺如下:
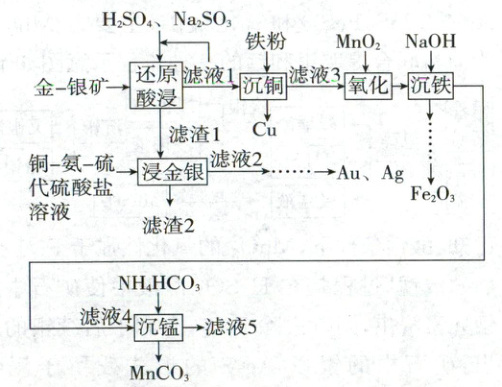
已知:①金-银矿中 Cu、Mn 元素的含量分别为0.19%、2.35%。
②$25\ \mathrm{° C}$时,${Mn(OH)_{2}}$的$K_{sp}$为$1.9× 10^{-13}$。
回答下列问题:
(1)基态 Cu 原子的价层电子排布式为_______。
(2)“还原酸浸”时,${MnO_{2}}$反应的离子方程式为_______。
(3)“浸金银”时,Au 溶解涉及的主要反应如下:
① ${Au + 5S_{2}O^{2-}_{3} + [Cu(NH_{3})_{4}]^{2+}\xlongequal{}[Au(S_{2}O_{3})_{2}]^{3-} + [Cu(S_{2}O_{3})_{3}]^{5-} + 4NH_{3}}$
②${4[Cu(S_{2}O_{3})_{3}]^{5-} + 16NH_{3} + O_{2} + 2H_{2}O\xlongequal{}4[Cu(NH_{3})_{4}]^{2+} + 4OH^{-} + 12S_{2}O^{2-}_{3}}$
上述过程中的催化剂为_______。
(4)“沉铜”前,“滤液 1”多次循环的目的为_______。
(5)根据“还原酸浸”“氧化”,推断${Fe^{3+}}$、${Cu^{2+}}$、${MnO_{2}}$的氧化性由强到弱的顺序为_______。
(6)$25\ \mathrm{° C}$“沉铁”后,调节“滤液 4”的 pH 至 8.0,无${Mn(OH)_{2}}$析出,则$c({Mn^{2+}})\leqslant$___${mol/L}$。
(7)一种锑锰(${Mn_{3}Sb}$)合金的立方晶胞结构如图。
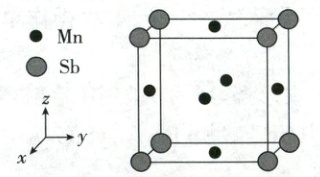
①该晶胞中,每个 Sb 周围与它最近且相等距离的 Mn 有_______个。
②$N_{A}$为阿伏加德罗常数的值,晶胞边长为$a\ \mathrm{nm}$,则晶体的密度_______g/cm3(列出计算式即可)。

已知:①金-银矿中 Cu、Mn 元素的含量分别为0.19%、2.35%。
②$25\ \mathrm{° C}$时,${Mn(OH)_{2}}$的$K_{sp}$为$1.9× 10^{-13}$。
回答下列问题:
(1)基态 Cu 原子的价层电子排布式为_______。
(2)“还原酸浸”时,${MnO_{2}}$反应的离子方程式为_______。
(3)“浸金银”时,Au 溶解涉及的主要反应如下:
① ${Au + 5S_{2}O^{2-}_{3} + [Cu(NH_{3})_{4}]^{2+}\xlongequal{}[Au(S_{2}O_{3})_{2}]^{3-} + [Cu(S_{2}O_{3})_{3}]^{5-} + 4NH_{3}}$
②${4[Cu(S_{2}O_{3})_{3}]^{5-} + 16NH_{3} + O_{2} + 2H_{2}O\xlongequal{}4[Cu(NH_{3})_{4}]^{2+} + 4OH^{-} + 12S_{2}O^{2-}_{3}}$
上述过程中的催化剂为_______。
(4)“沉铜”前,“滤液 1”多次循环的目的为_______。
(5)根据“还原酸浸”“氧化”,推断${Fe^{3+}}$、${Cu^{2+}}$、${MnO_{2}}$的氧化性由强到弱的顺序为_______。
(6)$25\ \mathrm{° C}$“沉铁”后,调节“滤液 4”的 pH 至 8.0,无${Mn(OH)_{2}}$析出,则$c({Mn^{2+}})\leqslant$___${mol/L}$。
(7)一种锑锰(${Mn_{3}Sb}$)合金的立方晶胞结构如图。

①该晶胞中,每个 Sb 周围与它最近且相等距离的 Mn 有_______个。
②$N_{A}$为阿伏加德罗常数的值,晶胞边长为$a\ \mathrm{nm}$,则晶体的密度_______g/cm3(列出计算式即可)。
答案:
1.(14分)
(1)$3d^{10}4s^{1}$
(2)$MnO_{2} + SO_{3}^{2-} + 2H^{+} = Mn^{2+} + SO_{4}^{2-} + H_{2}O$
(3)$[Cu(NH_{3})_{4}]^{2+}$
(4)富集$Cu^{2+}$和$Mn^{2+}$,提高$Cu^{2+}$及$Mn^{2+}$的浓度
(5)$MnO_{2} > Fe^{3+} > Cu^{2+}$
(6)0.19
(7)①12 ②$\frac{55 × 3 + 122}{N_{A} · a^{3} × 10^{-21}}$
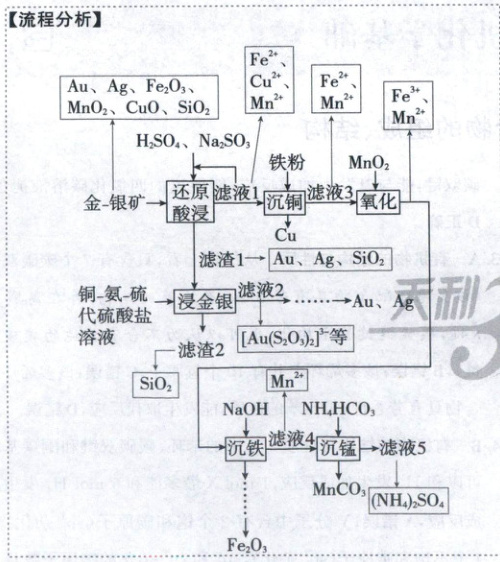
【解析】从金-银矿中提取并回收金属的工艺流程
(1)$Cu$为29号元素,所以基态$Cu$原子的价层电子排布式为$3d^{10}4s^{1}$。
(2)“还原酸浸”时,$MnO_{2}$在$Na_{2}SO_{3}$及硫酸作用下被还原为$Mn^{2+}$,离子方程式为$MnO_{2} + SO_{3}^{2-} + 2H^{+} = Mn^{2+} + SO_{4}^{2-} + H_{2}O$。
(3)将①×4+②可得离子方程式$4Au + 8S_{2}O_{3}^{2-} + O_{2} + 2H_{2}O = 4[Au(S_{2}O_{3})_{2}]^{3-} + 4OH^{-}$,所以在“浸金银”时,反应前后$[Cu(NH_{3})_{4}]^{2+}$未发生变化,为催化剂。
(4)由已知①可知金-银矿中的$Cu$、$Mn$含量低,所以“沉铜”前,“滤液1”多次循环可提高$Cu^{2+}$及$Mn^{2+}$的浓度。
(5)“还原酸浸”过程,$MnO_{2}$、$Fe^{3+}$被$SO_{3}^{2-}$还原,而$Cu^{2+}$未被还原,可知$Cu^{2+}$氧化性最弱,“氧化”过程,$MnO_{2}$将$Fe^{2+}$氧化为$Fe^{3+}$,可得$MnO_{2}$的氧化性强于$Fe^{3+}$,所以氧化性由强到弱的顺序为$MnO_{2} > Fe^{3+} > Cu^{2+}$。
(6)$pH = 8.0$时,$c(OH^{-}) = 10^{-6}mol/L$,无$Mn(OH)_{2}$析出,可得$c(Mn^{2+}) \leq \frac{K_{sp}[Mn(OH)_{2}]}{c^{2}(OH^{-})} = \frac{1.9 × 10^{-13}}{(10^{-6})^{2}}mol/L = 0.19mol/L$。
(7)①$Sb$位于晶胞的顶点,与其距离最近的$Mn$位于该顶点所相连的三个面的面心处,每个顶点有$\frac{1}{8}$个$Sb$属于晶胞所有,所以距离$Sb$最近且等距的$Mn$有$\frac{8 × 3}{2} = 12$个。②$Sb$位于晶胞的顶点,有$\frac{1}{8} × 8 = 1$个,$Mn$位于晶胞面心,有$\frac{1}{2} × 6 = 3$个,所以晶胞质量为$\frac{55 × 3 + 122}{N_{A}}g$,晶胞体积为$a^{3} × 10^{-21}cm^{3}$,晶胞密度$\rho = \frac{m}{V} = \frac{\frac{55 × 3 + 122}{N_{A}}}{a^{3} × 10^{-21}}g/cm^{3} = \frac{55 × 3 + 122}{N_{A} · a^{3} × 10^{-21}}g/cm^{3}$。
答67
1.(14分)
(1)$3d^{10}4s^{1}$
(2)$MnO_{2} + SO_{3}^{2-} + 2H^{+} = Mn^{2+} + SO_{4}^{2-} + H_{2}O$
(3)$[Cu(NH_{3})_{4}]^{2+}$
(4)富集$Cu^{2+}$和$Mn^{2+}$,提高$Cu^{2+}$及$Mn^{2+}$的浓度
(5)$MnO_{2} > Fe^{3+} > Cu^{2+}$
(6)0.19
(7)①12 ②$\frac{55 × 3 + 122}{N_{A} · a^{3} × 10^{-21}}$

【解析】从金-银矿中提取并回收金属的工艺流程
(1)$Cu$为29号元素,所以基态$Cu$原子的价层电子排布式为$3d^{10}4s^{1}$。
(2)“还原酸浸”时,$MnO_{2}$在$Na_{2}SO_{3}$及硫酸作用下被还原为$Mn^{2+}$,离子方程式为$MnO_{2} + SO_{3}^{2-} + 2H^{+} = Mn^{2+} + SO_{4}^{2-} + H_{2}O$。
(3)将①×4+②可得离子方程式$4Au + 8S_{2}O_{3}^{2-} + O_{2} + 2H_{2}O = 4[Au(S_{2}O_{3})_{2}]^{3-} + 4OH^{-}$,所以在“浸金银”时,反应前后$[Cu(NH_{3})_{4}]^{2+}$未发生变化,为催化剂。
(4)由已知①可知金-银矿中的$Cu$、$Mn$含量低,所以“沉铜”前,“滤液1”多次循环可提高$Cu^{2+}$及$Mn^{2+}$的浓度。
(5)“还原酸浸”过程,$MnO_{2}$、$Fe^{3+}$被$SO_{3}^{2-}$还原,而$Cu^{2+}$未被还原,可知$Cu^{2+}$氧化性最弱,“氧化”过程,$MnO_{2}$将$Fe^{2+}$氧化为$Fe^{3+}$,可得$MnO_{2}$的氧化性强于$Fe^{3+}$,所以氧化性由强到弱的顺序为$MnO_{2} > Fe^{3+} > Cu^{2+}$。
(6)$pH = 8.0$时,$c(OH^{-}) = 10^{-6}mol/L$,无$Mn(OH)_{2}$析出,可得$c(Mn^{2+}) \leq \frac{K_{sp}[Mn(OH)_{2}]}{c^{2}(OH^{-})} = \frac{1.9 × 10^{-13}}{(10^{-6})^{2}}mol/L = 0.19mol/L$。
(7)①$Sb$位于晶胞的顶点,与其距离最近的$Mn$位于该顶点所相连的三个面的面心处,每个顶点有$\frac{1}{8}$个$Sb$属于晶胞所有,所以距离$Sb$最近且等距的$Mn$有$\frac{8 × 3}{2} = 12$个。②$Sb$位于晶胞的顶点,有$\frac{1}{8} × 8 = 1$个,$Mn$位于晶胞面心,有$\frac{1}{2} × 6 = 3$个,所以晶胞质量为$\frac{55 × 3 + 122}{N_{A}}g$,晶胞体积为$a^{3} × 10^{-21}cm^{3}$,晶胞密度$\rho = \frac{m}{V} = \frac{\frac{55 × 3 + 122}{N_{A}}}{a^{3} × 10^{-21}}g/cm^{3} = \frac{55 × 3 + 122}{N_{A} · a^{3} × 10^{-21}}g/cm^{3}$。
答67
$2.【$模块融合$】(2025·$甘肃卷$,15 $分$)$研究人员设计了一种从铜冶炼烟尘$($主要含$ S、$${As_{2}O_{3}}$及$Cu、$$Zn、$$Pb $的硫酸盐$)$中高效回收砷、铜、锌和铅的绿色工艺$,$部分流程如下$:$
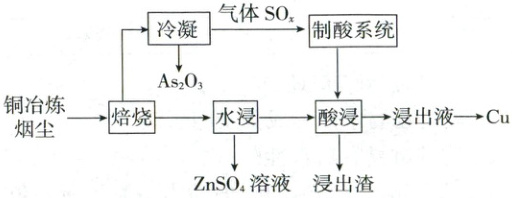
已知$:{As_{2}O_{3}}$熔点$314\ \mathrm{° C},$沸点$460\ \mathrm{° C};$
分解温度$:{CuO}\ \ 1\ 100\ \mathrm{° C},{CuSO_{4}}\ \ 560\ \mathrm{° C},{ZnSO_{4}}\ \ 680\ \mathrm{° C},{PbSO_{4}}$高于$1\ 000\ \mathrm{° C};$
$K_{sp}{(PbSO_{4})}=1.8× 10^{-8}。$
$(1)$设计焙烧温度为$600\ \mathrm{° C},$理由为_________。
$(2)$将${SO_{2}}$通入${Na_{2}CO_{3}}$和${Na_{2}S}$的混合溶液可制得${Na_{2}S_{2}O_{3}},$该反应的化学方程式为_________。
$(3)$酸浸的目的为_________。
$(4)$从浸出液得到$ Cu $的方法为_________(任写一种$)。$
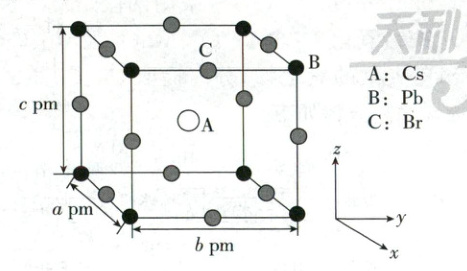
$(5) $某含$Pb$化合物是一种被广泛应用于太阳能电池领域的晶体材料,室温下该化合物晶胞如图所示,晶胞参数$a≠b,$$\alpha =\beta =\gamma =90°。$$Cs$与$Pb$之间的距离为__________ pm (用带有晶胞参数的代数式表示$);$该化合物的化学式为__________ M_{c_{s}}M_{p_{b}}和德罗常数$N_{A}$的代数式表示,质量$)。$

已知$:{As_{2}O_{3}}$熔点$314\ \mathrm{° C},$沸点$460\ \mathrm{° C};$
分解温度$:{CuO}\ \ 1\ 100\ \mathrm{° C},{CuSO_{4}}\ \ 560\ \mathrm{° C},{ZnSO_{4}}\ \ 680\ \mathrm{° C},{PbSO_{4}}$高于$1\ 000\ \mathrm{° C};$
$K_{sp}{(PbSO_{4})}=1.8× 10^{-8}。$
$(1)$设计焙烧温度为$600\ \mathrm{° C},$理由为_________。
$(2)$将${SO_{2}}$通入${Na_{2}CO_{3}}$和${Na_{2}S}$的混合溶液可制得${Na_{2}S_{2}O_{3}},$该反应的化学方程式为_________。
$(3)$酸浸的目的为_________。
$(4)$从浸出液得到$ Cu $的方法为_________(任写一种$)。$
$(5) $某含$Pb$化合物是一种被广泛应用于太阳能电池领域的晶体材料,室温下该化合物晶胞如图所示,晶胞参数$a≠b,$$\alpha =\beta =\gamma =90°。$$Cs$与$Pb$之间的距离为__________ pm (用带有晶胞参数的代数式表示$);$该化合物的化学式为__________ M_{c_{s}}M_{p_{b}}和德罗常数$N_{A}$的代数式表示,质量$)。$

答案:
2.(15分)
(1)使$As_{2}O_{3}$转化为气体分离出去,同时使$CuSO_{4}$分解为$CuO$,但其他硫酸盐不分解
(2)$4SO_{2} + 2Na_{2}S + Na_{2}CO_{3} = 3Na_{2}S_{2}O_{3} + CO_{2}$
(3)使$CuO$与硫酸反应生成$CuSO_{4}$,实现$CuO$与$PbSO_{4}$的分离
(4)用铁置换出铜(或电解法)
(5)$\frac{\sqrt{a^{2} + b^{2} + c^{2}}}{2}$ $CsPbBr_{3}$ $\frac{M_{Cs} + M_{Pb} + 3M_{Br}}{abcN_{A} × 10^{-30}}$
【解析】工艺流程
(1)由已知可知$CuSO_{4}$的分解温度为$560^{\circ}C$,故控制焙烧温度为$600^{\circ}C$可以使硫酸铜分解为氧化铜和$SO_{x}$,因硫酸锌和硫酸铅的分解温度高于$600^{\circ}C$,故二者不分解,同时由于温度高于$As_{2}O_{3}$的沸点,$As_{2}O_{3}$转化为气体分离出去。
(2)$SO_{2}$通入$Na_{2}CO_{3}$和$Na_{2}S$的混合溶液中反应的化学方程式为$4SO_{2} + Na_{2}CO_{3} + 2Na_{2}S = 3Na_{2}S_{2}O_{3} + CO_{2}$。
(3)酸浸的目的是用硫酸将$CuO$转化为$CuSO_{4}$,使$CuO$与$PbSO_{4}$分离。
(4)从浸出液中得到铜可采用铁置换或电解的方法。
(5)$Cs$位于晶胞体心,$Pb$位于晶胞顶点,二者之间的距离是晶胞体对角线的一半,体对角线长度为$\frac{\sqrt{a^{2} + b^{2} + c^{2}}}{2}pm$,则$Cs$与$Pb$之间的距离为$\frac{\sqrt{a^{2} + b^{2} + c^{2}}}{2}pm$。根据均摊法计算出每个晶胞中含有1个$Cs$、1个$Pb$和3个$Br$,因此该化合物的化学式为$CsPbBr_{3}$。该晶胞的质量为$\frac{M_{Cs} + M_{Pb} + 3M_{Br}}{N_{A}}g$,晶胞的体积为$abc × 10^{-30}cm^{3}$,因此晶体密度计算式为$\frac{M_{Cs} + M_{Pb} + 3M_{Br}}{abcN_{A} × 10^{-30}}g/cm^{3}$。
(1)使$As_{2}O_{3}$转化为气体分离出去,同时使$CuSO_{4}$分解为$CuO$,但其他硫酸盐不分解
(2)$4SO_{2} + 2Na_{2}S + Na_{2}CO_{3} = 3Na_{2}S_{2}O_{3} + CO_{2}$
(3)使$CuO$与硫酸反应生成$CuSO_{4}$,实现$CuO$与$PbSO_{4}$的分离
(4)用铁置换出铜(或电解法)
(5)$\frac{\sqrt{a^{2} + b^{2} + c^{2}}}{2}$ $CsPbBr_{3}$ $\frac{M_{Cs} + M_{Pb} + 3M_{Br}}{abcN_{A} × 10^{-30}}$
【解析】工艺流程
(1)由已知可知$CuSO_{4}$的分解温度为$560^{\circ}C$,故控制焙烧温度为$600^{\circ}C$可以使硫酸铜分解为氧化铜和$SO_{x}$,因硫酸锌和硫酸铅的分解温度高于$600^{\circ}C$,故二者不分解,同时由于温度高于$As_{2}O_{3}$的沸点,$As_{2}O_{3}$转化为气体分离出去。
(2)$SO_{2}$通入$Na_{2}CO_{3}$和$Na_{2}S$的混合溶液中反应的化学方程式为$4SO_{2} + Na_{2}CO_{3} + 2Na_{2}S = 3Na_{2}S_{2}O_{3} + CO_{2}$。
(3)酸浸的目的是用硫酸将$CuO$转化为$CuSO_{4}$,使$CuO$与$PbSO_{4}$分离。
(4)从浸出液中得到铜可采用铁置换或电解的方法。
(5)$Cs$位于晶胞体心,$Pb$位于晶胞顶点,二者之间的距离是晶胞体对角线的一半,体对角线长度为$\frac{\sqrt{a^{2} + b^{2} + c^{2}}}{2}pm$,则$Cs$与$Pb$之间的距离为$\frac{\sqrt{a^{2} + b^{2} + c^{2}}}{2}pm$。根据均摊法计算出每个晶胞中含有1个$Cs$、1个$Pb$和3个$Br$,因此该化合物的化学式为$CsPbBr_{3}$。该晶胞的质量为$\frac{M_{Cs} + M_{Pb} + 3M_{Br}}{N_{A}}g$,晶胞的体积为$abc × 10^{-30}cm^{3}$,因此晶体密度计算式为$\frac{M_{Cs} + M_{Pb} + 3M_{Br}}{abcN_{A} × 10^{-30}}g/cm^{3}$。
查看更多完整答案,请扫码查看


