2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第15页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
1. (2024·北京卷,3分)关于$\boldsymbol{{Na_{2}CO_{3}}}$和$\boldsymbol{{NaHCO_{3}}}$的下列说法中,不正确的是(
A.两种物质的溶液中,所含微粒的种类相同
B.可用${NaOH}$溶液使${NaHCO_{3}}$转化为${Na_{2}CO_{3}}$
C.利用二者热稳定性差异,可从它们的固体混合物中除去${NaHCO_{3}}$
D.室温下,二者饱和溶液的${pH}$差约为4,主要是由于它们的溶解度差异
D
)A.两种物质的溶液中,所含微粒的种类相同
B.可用${NaOH}$溶液使${NaHCO_{3}}$转化为${Na_{2}CO_{3}}$
C.利用二者热稳定性差异,可从它们的固体混合物中除去${NaHCO_{3}}$
D.室温下,二者饱和溶液的${pH}$差约为4,主要是由于它们的溶解度差异
答案:
1.D 钠及其化合物 $Na_2CO_3$和$NaHCO_3$的溶液中均存在$H_2O$、$H_2CO_3$、$H^+$、$OH^-$、$Na^+$、$CO_3^{2-}$、$HCO_3^-$,A正确;$NaHCO_3$加入$NaOH$溶液会发生反应:$NaOH + NaHCO_3══Na_2CO_3 + H_2O$,B正确;$NaHCO_3$受热易分解,转化为$Na_2CO_3$,而$Na_2CO_3$热稳定性较强,C正确;室温下$Na_2CO_3$和$NaHCO_3$饱和溶液pH相差较大的主要原因是$CO_3^{2-}$的水解程度远大于$HCO_3^-$,D错误。
归纳总结:除$Na_2CO_3$固体中的少量$NaHCO_3$可采用加热的方法;除$Na_2CO_3$溶液中的少量$NaHCO_3$可加入适量$NaOH$溶液;除$NaHCO_3$溶液中的少量$Na_2CO_3$可通入足量$CO_2$气体。
归纳总结:除$Na_2CO_3$固体中的少量$NaHCO_3$可采用加热的方法;除$Na_2CO_3$溶液中的少量$NaHCO_3$可加入适量$NaOH$溶液;除$NaHCO_3$溶液中的少量$Na_2CO_3$可通入足量$CO_2$气体。
2. (2024·重庆卷,3分)单质$\boldsymbol{{M}}$的相关转化如下所示。下列说法错误的是(
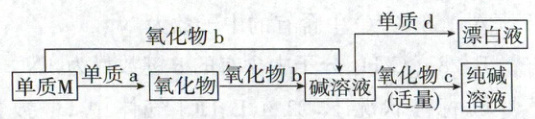
A.${a}$可使灼热的铜变黑
B.${b}$可与红热的铁产生气体
C.${c}$可使燃烧的镁条熄灭
D.${d}$可使湿润的淀粉碘化钾试纸变蓝
C
)
A.${a}$可使灼热的铜变黑
B.${b}$可与红热的铁产生气体
C.${c}$可使燃烧的镁条熄灭
D.${d}$可使湿润的淀粉碘化钾试纸变蓝
答案:
2.C 无机综合推断
【物质分析】$Na\overset{H_2O}{\underset{O_2}{\rightleftarrows}}Na_2O$或$Na_2O_2\overset{H_2O}{\rightarrow}NaOH\overset{Cl_2}{\rightarrow}$漂白液,$\downarrow CO_2(适量)$纯碱溶液。$O_2$可与灼热的铜反应生成$CuO$,使铜变黑,A正确;$H_2O$可与红热的铁反应生成$Fe_3O_4$和$H_2$,B正确;镁条可在$CO_2$中燃烧生成$MgO$和C,C错误;$Cl_2$具有强氧化性,能与$KI$溶液反应生成$I_2$,可使湿润的淀粉碘化钾试纸变蓝,D正确。
【物质分析】$Na\overset{H_2O}{\underset{O_2}{\rightleftarrows}}Na_2O$或$Na_2O_2\overset{H_2O}{\rightarrow}NaOH\overset{Cl_2}{\rightarrow}$漂白液,$\downarrow CO_2(适量)$纯碱溶液。$O_2$可与灼热的铜反应生成$CuO$,使铜变黑,A正确;$H_2O$可与红热的铁反应生成$Fe_3O_4$和$H_2$,B正确;镁条可在$CO_2$中燃烧生成$MgO$和C,C错误;$Cl_2$具有强氧化性,能与$KI$溶液反应生成$I_2$,可使湿润的淀粉碘化钾试纸变蓝,D正确。
3. (2021·山东卷,2分)工业上以$\boldsymbol{{SO_{2}}}$和纯碱为原料制备无水$\boldsymbol{{NaHSO_{3}}}$的主要流程如图,下列说法错误的是(
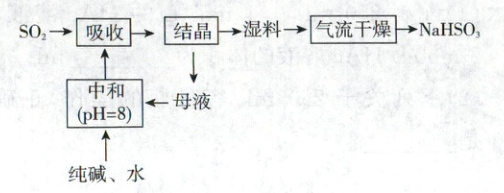
A.吸收过程中有气体生成
B.结晶后母液中含有${NaHCO_{3}}$
C.气流干燥湿料时温度不宜过高
D.中和后溶液中含${Na_{2}SO_{3}}$和${NaHCO_{3}}$
B
)
A.吸收过程中有气体生成
B.结晶后母液中含有${NaHCO_{3}}$
C.气流干燥湿料时温度不宜过高
D.中和后溶液中含${Na_{2}SO_{3}}$和${NaHCO_{3}}$
答案:
3.B 无机流程分析 结晶后母液中的溶质为$NaHSO_3$,B错误。
4. (2021·1月浙江卷,2分)下列“类比”合理的是(
A.${Na}$与${H_{2}O}$反应生成${NaOH}$和${H_{2}}$,则${Fe}$与${H_{2}O}$反应生成${Fe(OH)_{3}}$和${H_{2}}$
B.${NaClO}$溶液与${CO_{2}}$反应生成${NaHCO_{3}}$和${HClO}$,则${NaClO}$溶液与${SO_{2}}$反应生成${NaHSO_{3}}$和${HClO}$
C.${Na_{3}N}$与盐酸反应生成${NaCl}$和${NH_{4}Cl}$,则${Mg_{3}N_{2}}$与盐酸反应生成${MgCl_{2}}$和${NH_{4}Cl}$
D.${NaOH}$溶液与少量${AgNO_{3}}$溶液反应生成${Ag_{2}O}$和${NaNO_{3}}$,则氨水与少量${AgNO_{3}}$溶液反应生成${Ag_{2}O}$和${NH_{4}NO_{3}}$
C
)A.${Na}$与${H_{2}O}$反应生成${NaOH}$和${H_{2}}$,则${Fe}$与${H_{2}O}$反应生成${Fe(OH)_{3}}$和${H_{2}}$
B.${NaClO}$溶液与${CO_{2}}$反应生成${NaHCO_{3}}$和${HClO}$,则${NaClO}$溶液与${SO_{2}}$反应生成${NaHSO_{3}}$和${HClO}$
C.${Na_{3}N}$与盐酸反应生成${NaCl}$和${NH_{4}Cl}$,则${Mg_{3}N_{2}}$与盐酸反应生成${MgCl_{2}}$和${NH_{4}Cl}$
D.${NaOH}$溶液与少量${AgNO_{3}}$溶液反应生成${Ag_{2}O}$和${NaNO_{3}}$,则氨水与少量${AgNO_{3}}$溶液反应生成${Ag_{2}O}$和${NH_{4}NO_{3}}$
答案:
4.C 钠及其化合物 $Na$与水反应生成$NaOH$和$H_2$,而$Fe$与水反应生成$Fe_3O_4$和$H_2$,A错误;$NaClO$溶液与$CO_2$反应生成$NaHCO_3$和$HClO$,而$NaClO$溶液与$SO_2$发生的是氧化还原反应,B错误;两种氮化物均能与水反应生成氢氧化物和氨气,氢氧化物和氨气均能与盐酸反应生成对应的金属氯化物和氯化铵,C正确;$Ag_2O$不溶于过量的$NaOH$溶液,但能溶于过量的氨水,故氨水与少量$AgNO_3$溶液反应会生成$[Ag(NH_3)_2]OH$和$NH_4NO_3$,D错误。
5. (2021·湖南卷,12分)碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,并测定产品中少量碳酸氢钠的含量,过程如下:
步骤Ⅰ.$\boldsymbol{{Na_{2}CO_{3}}}$的制备
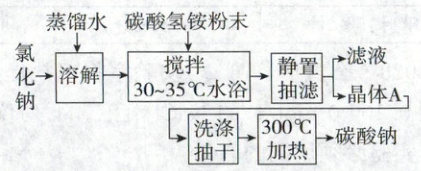
步骤Ⅱ.产品中$\boldsymbol{{NaHCO_{3}}}$含量测定
①称取产品2.500g,用蒸馏水溶解,定容于$250\ {mL}$容量瓶中;
②移取$25.00\ {mL}$上述溶液于锥形瓶,加入2滴指示剂${M}$,用0.1000mol/L盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸$V_{1}\ {mL}$;
③在上述锥形瓶中再加入2滴指示剂${N}$,继续用0.1000mol/L盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸$V_{2}\ {mL}$;
④平行测定三次,$V_{1}$平均值为22.45,$V_{2}$平均值为23.51。
已知:(ⅰ)当温度超过$35\ ^{\circ}C$时,${NH_{4}HCO_{3}}$开始分解。
(ⅱ)相关盐在不同温度下的溶解度表(${g/100\ {g}\ H_{2}O}$)
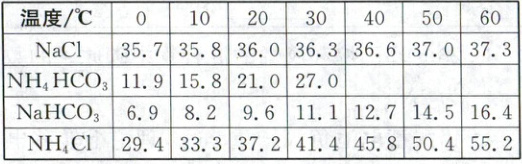
回答下列问题:
(1)步骤Ⅰ中晶体${A}$的化学式为
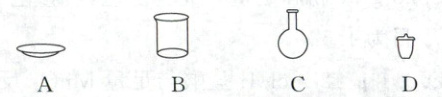
(2)步骤Ⅰ中“$300\ ^{\circ}C$加热”所选用的仪器是
(3)指示剂${N}$为
(4)产品中${NaHCO_{3}}$的质量分数为
(5)第一滴定终点时,某同学俯视读数,其他操作均正确,则${NaHCO_{3}}$质量分数的计算结果
步骤Ⅰ.$\boldsymbol{{Na_{2}CO_{3}}}$的制备

步骤Ⅱ.产品中$\boldsymbol{{NaHCO_{3}}}$含量测定
①称取产品2.500g,用蒸馏水溶解,定容于$250\ {mL}$容量瓶中;
②移取$25.00\ {mL}$上述溶液于锥形瓶,加入2滴指示剂${M}$,用0.1000mol/L盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸$V_{1}\ {mL}$;
③在上述锥形瓶中再加入2滴指示剂${N}$,继续用0.1000mol/L盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸$V_{2}\ {mL}$;
④平行测定三次,$V_{1}$平均值为22.45,$V_{2}$平均值为23.51。
已知:(ⅰ)当温度超过$35\ ^{\circ}C$时,${NH_{4}HCO_{3}}$开始分解。
(ⅱ)相关盐在不同温度下的溶解度表(${g/100\ {g}\ H_{2}O}$)

回答下列问题:
(1)步骤Ⅰ中晶体${A}$的化学式为
$NaHCO_3$
,晶体${A}$能够析出的原因是30~35$^{\circ}C$,碳酸氢钠溶解度相对最小,最易析出
。(2)步骤Ⅰ中“$300\ ^{\circ}C$加热”所选用的仪器是
D
(填标号)。
(3)指示剂${N}$为
甲基橙
,描述第二滴定终点前后颜色变化黄色变橙色
。(4)产品中${NaHCO_{3}}$的质量分数为
3.56%
(保留三位有效数字)。(5)第一滴定终点时,某同学俯视读数,其他操作均正确,则${NaHCO_{3}}$质量分数的计算结果
偏大
(填“偏大”“偏小”或“无影响”)。
答案:
5.(12分)
(1)$NaHCO_3$ 30~35$^{\circ}C$,碳酸氢钠溶解度相对最小,最易析出
(2)D
(3)甲基橙 黄色变橙色
(4)3.56%
(5)偏大
【解析】化学实验综合
(1)晶体A为氯化钠溶液和碳酸氢铵粉末混合在30~35$^{\circ}C$下水浴所得,根据题干中已知信息可得此温度下碳酸氢钠溶解度相对最小,易析出,所以晶体A为$NaHCO_3$。
(2)步骤Ⅰ中300$^{\circ}C$加热的为碳酸氢钠固体,加热固体用坩埚。
(3)为测定碳酸钠产品中碳酸氢钠的含量,滴定时均选用盐酸作为标准溶液,第一滴定终点的现象为溶液由红色变至近无色,可判断第一滴定终点为碳酸氢钠溶液,指示剂M为酚酞溶液,第二次滴定$NaHCO_3$转化为$NaCl$和$CO_2$、$H_2O$,滴定终点溶液呈酸性,则选择甲基橙作指示剂,滴定终点前后颜色变化为黄色变至橙色。
(4)两次滴定发生的反应分别为①$Na_2CO_3 + HCl══NaHCO_3 + NaCl$;②$NaHCO_3 + HCl══NaCl + CO_2\uparrow + H_2O$,题中2.500g产品配制250mL溶液只取25mL,则两次滴定消耗盐酸的物质的量的差值的10倍就等于产品中碳酸氢钠的物质的量,$m(NaHCO_3)=(23.51 - 22.45)mL×0.1000mol/L×10^{-3}×M(NaHCO_3)×10 = 8.904×10^{-2}g$,所以产品中$NaHCO_3$质量分数为$\frac{8.904×10^{-2}g}{2.500g}×100\%≈3.56\%$。
(5)若第一滴定终点俯视读数,则$V_1$偏小,$NaHCO_3$的物质的量偏大,故其质量分数偏大。
方法点拨:实验题的关键在于抓住题干已知信息以及各步骤的现象,根据现象推导结论或试剂。此题考查了酸碱指示剂的变色范围,酚酞:8.2~10.0,甲基橙:3.1~4.4,考查简单的计算,注意题上出现的数据,比如250mL中取25mL,易出错。
(1)$NaHCO_3$ 30~35$^{\circ}C$,碳酸氢钠溶解度相对最小,最易析出
(2)D
(3)甲基橙 黄色变橙色
(4)3.56%
(5)偏大
【解析】化学实验综合
(1)晶体A为氯化钠溶液和碳酸氢铵粉末混合在30~35$^{\circ}C$下水浴所得,根据题干中已知信息可得此温度下碳酸氢钠溶解度相对最小,易析出,所以晶体A为$NaHCO_3$。
(2)步骤Ⅰ中300$^{\circ}C$加热的为碳酸氢钠固体,加热固体用坩埚。
(3)为测定碳酸钠产品中碳酸氢钠的含量,滴定时均选用盐酸作为标准溶液,第一滴定终点的现象为溶液由红色变至近无色,可判断第一滴定终点为碳酸氢钠溶液,指示剂M为酚酞溶液,第二次滴定$NaHCO_3$转化为$NaCl$和$CO_2$、$H_2O$,滴定终点溶液呈酸性,则选择甲基橙作指示剂,滴定终点前后颜色变化为黄色变至橙色。
(4)两次滴定发生的反应分别为①$Na_2CO_3 + HCl══NaHCO_3 + NaCl$;②$NaHCO_3 + HCl══NaCl + CO_2\uparrow + H_2O$,题中2.500g产品配制250mL溶液只取25mL,则两次滴定消耗盐酸的物质的量的差值的10倍就等于产品中碳酸氢钠的物质的量,$m(NaHCO_3)=(23.51 - 22.45)mL×0.1000mol/L×10^{-3}×M(NaHCO_3)×10 = 8.904×10^{-2}g$,所以产品中$NaHCO_3$质量分数为$\frac{8.904×10^{-2}g}{2.500g}×100\%≈3.56\%$。
(5)若第一滴定终点俯视读数,则$V_1$偏小,$NaHCO_3$的物质的量偏大,故其质量分数偏大。
方法点拨:实验题的关键在于抓住题干已知信息以及各步骤的现象,根据现象推导结论或试剂。此题考查了酸碱指示剂的变色范围,酚酞:8.2~10.0,甲基橙:3.1~4.4,考查简单的计算,注意题上出现的数据,比如250mL中取25mL,易出错。
查看更多完整答案,请扫码查看


