2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第109页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
1.【模块融合】(2025·广东卷,14分)我国是金属材料生产大国,绿色生产是必由之路。一种从多金属精矿中提取Fe、Cu、Ni等并探究新型绿色冶铁方法的工艺如下。
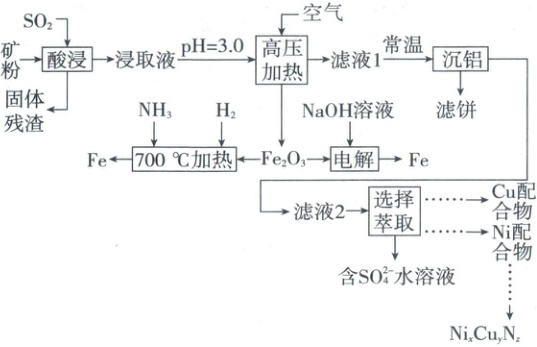
已知:多金属精矿中主要含有Fe、Al、Cu、Ni、O等元素。
(1)“酸浸”中,提高浸取速率的措施有_________(写一条)。
(2)“高压加热”时,生成${Fe_{2}O_{3}}$的离子方程式为_________${ + O_{2} + }$_______${H_{2}O \xlongequal[\triangle]{高压} }$_______${Fe_{2}O_{3}\downarrow + }$_______${H^{+}}$
(3)“沉铝”时,${pH}$最高可调至_________(溶液体积变化可忽略)。
已知:“滤液1”中$c{(Cu^{2+})}=0.022\ mol/L$,$c{(Ni^{2+})}=0.042\ mol/L$。

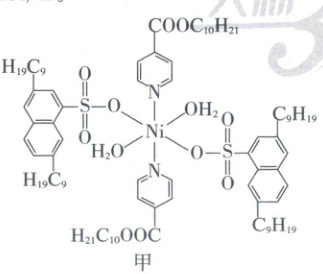
(4)“选择萃取”中,镍形成如图甲的配合物。镍易进入有机相的原因有_________。
A. 镍与N、O形成配位键
B. 配位时${Ni^{2+}}$被还原
C. 配合物与水能形成分子间氢键
D. 烷基链具有疏水性
(5)${Ni_{x}Cu_{y}N_{z}}$晶体的立方晶胞中原子所处位置如图乙。已知:同种位置原子相同,相邻原子间的最近距离之比$d_{{Ni-Cu}}:d_{{Ni-N}}=\sqrt{2}:1$,则$x:y:z=$_______;晶体中与${Cu}$原子最近且等距离的原子的数目为_________。

(6)①“$700\ °C$加热”步骤中,混合气体中仅加少量${H_{2}}$,但借助工业合成氨的逆反应,可使Fe不断生成。该步骤发生反应的化学方程式为_________和_________。
②“电解”时,${Fe_{2}O_{3}}$颗粒分散于溶液中,以Fe片、石墨棒为电极,画出电解池示意图并做相应标注。
③与传统高炉炼铁工艺相比,上述两种新型冶铁方法所体现“绿色化学”思想的共同点是_________(写一条)。

已知:多金属精矿中主要含有Fe、Al、Cu、Ni、O等元素。
(1)“酸浸”中,提高浸取速率的措施有_________(写一条)。
(2)“高压加热”时,生成${Fe_{2}O_{3}}$的离子方程式为_________${ + O_{2} + }$_______${H_{2}O \xlongequal[\triangle]{高压} }$_______${Fe_{2}O_{3}\downarrow + }$_______${H^{+}}$
(3)“沉铝”时,${pH}$最高可调至_________(溶液体积变化可忽略)。
已知:“滤液1”中$c{(Cu^{2+})}=0.022\ mol/L$,$c{(Ni^{2+})}=0.042\ mol/L$。

(4)“选择萃取”中,镍形成如图甲的配合物。镍易进入有机相的原因有_________。
A. 镍与N、O形成配位键
B. 配位时${Ni^{2+}}$被还原
C. 配合物与水能形成分子间氢键
D. 烷基链具有疏水性
(5)${Ni_{x}Cu_{y}N_{z}}$晶体的立方晶胞中原子所处位置如图乙。已知:同种位置原子相同,相邻原子间的最近距离之比$d_{{Ni-Cu}}:d_{{Ni-N}}=\sqrt{2}:1$,则$x:y:z=$_______;晶体中与${Cu}$原子最近且等距离的原子的数目为_________。


(6)①“$700\ °C$加热”步骤中,混合气体中仅加少量${H_{2}}$,但借助工业合成氨的逆反应,可使Fe不断生成。该步骤发生反应的化学方程式为_________和_________。
②“电解”时,${Fe_{2}O_{3}}$颗粒分散于溶液中,以Fe片、石墨棒为电极,画出电解池示意图并做相应标注。
③与传统高炉炼铁工艺相比,上述两种新型冶铁方法所体现“绿色化学”思想的共同点是_________(写一条)。
答案:
(1)适当升高温度(或增大$\mathrm{SO_2}$分压或降低矿粉的粒度或增大酸的浓度)
(2)$4\mathrm{Fe^{2+}}$ $4$ $2$ $8$
(3)$5.00$
(4)AD
(5)$3:1:1$ $12$
(6)①$3\mathrm{H_2}+\mathrm{Fe_2O_3}\xlongequal{700° C}2\mathrm{Fe}+3\mathrm{H_2O}$ $2\mathrm{NH_3}\xlongequal{\mathrm{Fe}}\mathrm{N_2}+3\mathrm{H_2}$
②
 ③污染性气体排放量少(或低碳排放)
③污染性气体排放量少(或低碳排放)
(1)适当升高温度(或增大$\mathrm{SO_2}$分压或降低矿粉的粒度或增大酸的浓度)
(2)$4\mathrm{Fe^{2+}}$ $4$ $2$ $8$
(3)$5.00$
(4)AD
(5)$3:1:1$ $12$
(6)①$3\mathrm{H_2}+\mathrm{Fe_2O_3}\xlongequal{700° C}2\mathrm{Fe}+3\mathrm{H_2O}$ $2\mathrm{NH_3}\xlongequal{\mathrm{Fe}}\mathrm{N_2}+3\mathrm{H_2}$
②
 ③污染性气体排放量少(或低碳排放)
③污染性气体排放量少(或低碳排放) 2.(2025·山东卷,12分)采用两段焙烧—水浸法从铁锰氧化矿(含${Fe_{2}O_{3}}$、${MnO_{2}}$及${Co}$、${Cu}$、${Ca}$、${Si}$等元素的氧化物)分离提取${Cu}$、${Co}$、${Mn}$等元素,工艺流程如下:
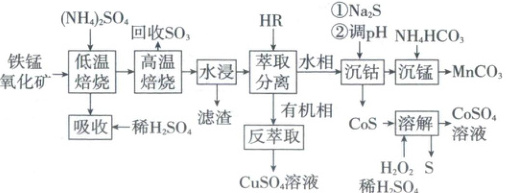
已知:该工艺条件下,${(NH_{4})_{2}SO_{4}}$低温分解生成${NH_{4}HSO_{4}}$,高温则完全分解为气体;${Fe_{2}(SO_{4})_{3}}$在$650\ °C$完全分解,其他金属硫酸盐分解温度均高于$700\ °C$。
回答下列问题:
(1)“低温焙烧”时金属氧化物均转化为硫酸盐。${MnO_{2}}$与${NH_{4}HSO_{4}}$反应转化为${MnSO_{4}}$时有${N_{2}}$生成,该反应的化学方程式为
“高温焙烧”温度为$650\ °C$,“水浸”所得滤渣主要成分除${SiO_{2}}$外还含有
(2)在${(NH_{4})_{2}SO_{4}}$投料量不变的情况下,与两段焙烧工艺相比,直接“高温焙烧”,“水浸”时金属元素的浸出率
(3)HR萃取${Cu^{2+}}$反应为${2HR(有机相) + Cu^{2+}(水相)⇌ CuR_{2}(有机相) + 2H^{+}(水相)}$。“反萃取”时加入的试剂为
(4)“沉钴”中,${pH}=4$时${Co^{2+}}$恰好沉淀完全$[c{(Co^{2+})}=1× 10^{-5}\ mol/L]$,则此时溶液中$c{(H_{2}S)}=$
(5)“沉锰”所得滤液并入“吸收”液中,经处理后所得产品导入

已知:该工艺条件下,${(NH_{4})_{2}SO_{4}}$低温分解生成${NH_{4}HSO_{4}}$,高温则完全分解为气体;${Fe_{2}(SO_{4})_{3}}$在$650\ °C$完全分解,其他金属硫酸盐分解温度均高于$700\ °C$。
回答下列问题:
(1)“低温焙烧”时金属氧化物均转化为硫酸盐。${MnO_{2}}$与${NH_{4}HSO_{4}}$反应转化为${MnSO_{4}}$时有${N_{2}}$生成,该反应的化学方程式为
3MnO₂+3NH₄HSO₄\xlongequal{低温焙烧}3MnSO₄+N₂↑+6H₂O+NH₃↑
。“高温焙烧”温度为$650\ °C$,“水浸”所得滤渣主要成分除${SiO_{2}}$外还含有
CaSO₄和Fe₂O₃
(填化学式)。(2)在${(NH_{4})_{2}SO_{4}}$投料量不变的情况下,与两段焙烧工艺相比,直接“高温焙烧”,“水浸”时金属元素的浸出率
减小
(填“增大”“减小”或“不变”)。(3)HR萃取${Cu^{2+}}$反应为${2HR(有机相) + Cu^{2+}(水相)⇌ CuR_{2}(有机相) + 2H^{+}(水相)}$。“反萃取”时加入的试剂为
H₂SO₄
(填化学式)。(4)“沉钴”中,${pH}=4$时${Co^{2+}}$恰好沉淀完全$[c{(Co^{2+})}=1× 10^{-5}\ mol/L]$,则此时溶液中$c{(H_{2}S)}=$
4×10⁻⁴
$mol/L$。已知:$K_{a1}{(H_{2}S)}=1× 10^{-7}$,$K_{a2}{(H_{2}S)}=1× 10^{-13}$,$K_{sp}{(CoS)}=4× 10^{-21}$。${CoS}$“溶解”时发生反应的离子方程式为CoS+H₂O₂+2H⁺\xlongequal{}Co²⁺+S+2H₂O
。(5)“沉锰”所得滤液并入“吸收”液中,经处理后所得产品导入
低温焙烧
(填操作单元名称)循环利用。
答案:
(1)$3MnO_{2}+3NH_{4}HSO_{4}\xlongequal{低温焙烧}3MnSO_{4}+N_{2}\uparrow +6H_{2}O+NH_{3}\uparrow$
$CaSO_{4}$和$Fe_{2}O_{3}$
(2)减小
(3)${H_{2}SO_{4}}$
(4)$4×10^{-4}$ ${CoS + H_{2}O_{2} + 2H^{+}\xlongequal{}Co^{2 + } + S + 2H_{2}O}$
(5)低温焙烧
(1)$3MnO_{2}+3NH_{4}HSO_{4}\xlongequal{低温焙烧}3MnSO_{4}+N_{2}\uparrow +6H_{2}O+NH_{3}\uparrow$
$CaSO_{4}$和$Fe_{2}O_{3}$
(2)减小
(3)${H_{2}SO_{4}}$
(4)$4×10^{-4}$ ${CoS + H_{2}O_{2} + 2H^{+}\xlongequal{}Co^{2 + } + S + 2H_{2}O}$
(5)低温焙烧
查看更多完整答案,请扫码查看


