2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第105页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
1. (2025·湖北卷,14分)氟化钠是一种用途广泛的氟化试剂,通过以下两种工艺制备:
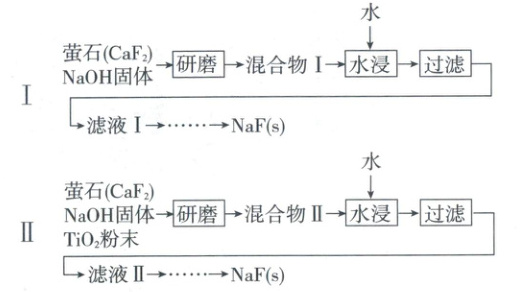
已知:室温下,${TiO_{2}}$是难溶酸性氧化物,${CaTiO_{3}}$的溶解度极低。
$20\ ^{\circ}C$时,${NaF}$的溶解度为$4.06\ g/100\ g$水,温度对其溶解度影响不大。
回答下列问题:
(1)基态氟离子的电子排布式为
(2)$20\ ^{\circ}C$时,${CaF_{2}}$饱和溶液的浓度为$c\ mol/L$,用$c$表示${CaF_{2}}$的溶度积$K_{sp}=$
(3)工艺Ⅰ中研磨引发的固相反应为${CaF_{2} +2NaOH\xlongequal{}Ca(OH)_{2} +2NaF}$。分析混合物Ⅰ,测得反应的转化率为$78\%$。水浸分离,${NaF}$的产率仅为$8\%$。
①工艺Ⅰ的固相反应
②分析以上产率变化,推测溶解度$S\left({CaF_{2}}\right)$
(4)工艺Ⅱ水浸后${NaF}$的产率可达$81\%$,写出工艺Ⅱ的总化学反应方程式
(5)从滤液Ⅱ获取${NaF}$晶体的操作为
a. 蒸发至大量晶体析出,趁热过滤
b. 蒸发至有晶膜出现后冷却结晶,过滤
(6)研磨能够促进固相反应的原因可能有
a. 增大反应物间的接触面积
b. 破坏反应物的化学键
c. 降低反应的活化能
d. 研钵表面跟反应物更好接触

已知:室温下,${TiO_{2}}$是难溶酸性氧化物,${CaTiO_{3}}$的溶解度极低。
$20\ ^{\circ}C$时,${NaF}$的溶解度为$4.06\ g/100\ g$水,温度对其溶解度影响不大。
回答下列问题:
(1)基态氟离子的电子排布式为
$1s^{2}2s^{2}2p^{6}$
。(2)$20\ ^{\circ}C$时,${CaF_{2}}$饱和溶液的浓度为$c\ mol/L$,用$c$表示${CaF_{2}}$的溶度积$K_{sp}=$
$4c^{3}$
。(3)工艺Ⅰ中研磨引发的固相反应为${CaF_{2} +2NaOH\xlongequal{}Ca(OH)_{2} +2NaF}$。分析混合物Ⅰ,测得反应的转化率为$78\%$。水浸分离,${NaF}$的产率仅为$8\%$。
①工艺Ⅰ的固相反应
正向
(填“正向”或“逆向”)进行程度大。②分析以上产率变化,推测溶解度$S\left({CaF_{2}}\right)$
<
(填“$>$”或“$<$”)$S{[Ca(OH)_{2}]}$。(4)工艺Ⅱ水浸后${NaF}$的产率可达$81\%$,写出工艺Ⅱ的总化学反应方程式
$CaF_{2} + 2NaOH + TiO_{2} \longrightarrow CaTiO_{3} + 2NaF + H_{2}O$
。(5)从滤液Ⅱ获取${NaF}$晶体的操作为
a
(填标号)。a. 蒸发至大量晶体析出,趁热过滤
b. 蒸发至有晶膜出现后冷却结晶,过滤
(6)研磨能够促进固相反应的原因可能有
ab
(填标号)。a. 增大反应物间的接触面积
b. 破坏反应物的化学键
c. 降低反应的活化能
d. 研钵表面跟反应物更好接触
答案:
1.(14分)
(1)$1s^{2}2s^{2}2p^{6}$
(2)$4c^{3}$
(3)①正向 ②<
(4)$CaF_{2} + 2NaOH + TiO_{2} \longrightarrow CaTiO_{3} + 2NaF + H_{2}O$
(5)a
(6)ab
【解析】$NaF$的制备
(1)基态$F^{-}$的电子排布式为$1s^{2}2s^{2}2p^{6}$。
(2)$CaF_{2}(s)\rightleftharpoons Ca^{2+}(aq) + 2F^{-}(aq)$,$K_{sp} = c(Ca^{2+}) ×$ $c^{2}(F^{-}) = c×(2c)^{2} = 4c^{3}$。
(3)①该反应的转化率为$78\%$,故正向进行程度大;②水浸后$NaF$产率低,说明水浸后反应逆向移动,则$S(CaF_{2}) < S[Ca(OH)_{2}]$。
(4)根据信息知,总化学方程式为$CaF_{2} + 2NaOH + TiO_{2}\longrightarrow CaTiO_{3} + 2NaF + H_{2}O$。
(5)由于温度对$NaF$的溶解度影响不大,可采用蒸发至大量晶体析出,再趁热过滤的方法获得$NaF$晶体(趁热过滤可以保证杂质溶解度大而不析出),选择 a。
(6)研磨可以增大物质间的接触面积,破坏反应物的化学键,促进固相反应发生,故选择 ab。
(1)$1s^{2}2s^{2}2p^{6}$
(2)$4c^{3}$
(3)①正向 ②<
(4)$CaF_{2} + 2NaOH + TiO_{2} \longrightarrow CaTiO_{3} + 2NaF + H_{2}O$
(5)a
(6)ab
【解析】$NaF$的制备
(1)基态$F^{-}$的电子排布式为$1s^{2}2s^{2}2p^{6}$。
(2)$CaF_{2}(s)\rightleftharpoons Ca^{2+}(aq) + 2F^{-}(aq)$,$K_{sp} = c(Ca^{2+}) ×$ $c^{2}(F^{-}) = c×(2c)^{2} = 4c^{3}$。
(3)①该反应的转化率为$78\%$,故正向进行程度大;②水浸后$NaF$产率低,说明水浸后反应逆向移动,则$S(CaF_{2}) < S[Ca(OH)_{2}]$。
(4)根据信息知,总化学方程式为$CaF_{2} + 2NaOH + TiO_{2}\longrightarrow CaTiO_{3} + 2NaF + H_{2}O$。
(5)由于温度对$NaF$的溶解度影响不大,可采用蒸发至大量晶体析出,再趁热过滤的方法获得$NaF$晶体(趁热过滤可以保证杂质溶解度大而不析出),选择 a。
(6)研磨可以增大物质间的接触面积,破坏反应物的化学键,促进固相反应发生,故选择 ab。
2. (2024·江西卷,14分)稀土是国家的战略资源之一。以下是一种以独居石[主要成分为${CePO_{4}}$,含有${Th_{3}(PO_{4})_{4}}$、${U_{3}O_{8}}$和少量镭杂质]为原料制备${CeCl_{3}}· n{H_{2}O}$的工艺流程图。
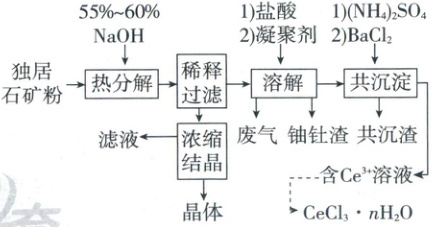
已知:ⅰ.$K_{sp}\left[{Th(OH)_{4}}\right]=4.0× 10^{-45}$,
$K_{sp}\left[{Ce(OH)_{3}}\right]=1.6× 10^{-20}$,
$K_{sp}\left[{Ce(OH)_{4}}\right]=2.0× 10^{-48}$
ⅱ.镭为第Ⅱ$A$族元素
回答下列问题:
(1)关于独居石的热分解,以下说法正确的是
a. 降低压强,分解速率增大
b. 降低温度,分解速率降低
c. 反应时间越长,分解速率越大
d. 提高搅拌速度,分解速率降低
(2)${Na_{2}U_{2}O_{7}}$中铀元素的化合价为
(3)浓缩结晶后,得到的晶体产物化学式为
(4)溶解阶段,将溶液${pH}$先调到$1.5\sim 2.0$,反应后再回调至$4.5$。
①盐酸溶解${Ce(OH)_{4}}$的离子方程式为
②当溶液${pH}=4.5$时,$c{(Th^{4+})}=$
(5)以${BaSO_{4}}$为载体形成共沉淀,目的是去除杂质

已知:ⅰ.$K_{sp}\left[{Th(OH)_{4}}\right]=4.0× 10^{-45}$,
$K_{sp}\left[{Ce(OH)_{3}}\right]=1.6× 10^{-20}$,
$K_{sp}\left[{Ce(OH)_{4}}\right]=2.0× 10^{-48}$
ⅱ.镭为第Ⅱ$A$族元素
回答下列问题:
(1)关于独居石的热分解,以下说法正确的是
b
(填标号)。a. 降低压强,分解速率增大
b. 降低温度,分解速率降低
c. 反应时间越长,分解速率越大
d. 提高搅拌速度,分解速率降低
(2)${Na_{2}U_{2}O_{7}}$中铀元素的化合价为
+6
,热分解阶段${U_{3}O_{8}}$生成${Na_{2}U_{2}O_{7}}$的化学反应方程式为$U_{3}O_{8} + 6NaOH + O_{2}\xlongequal{\triangle}3Na_{2}U_{2}O_{7} + 3H_{2}O$
。(3)浓缩结晶后,得到的晶体产物化学式为
$Na_{3}PO_{4}$
,滤液可用于热分解
阶段循环利用,避免产生大量的高碱度废水。(4)溶解阶段,将溶液${pH}$先调到$1.5\sim 2.0$,反应后再回调至$4.5$。
①盐酸溶解${Ce(OH)_{4}}$的离子方程式为
$2Ce(OH)_{4} + 8H^{+} + 2Cl^{-}\longrightarrow 2Ce^{3+} + Cl_{2}\uparrow + 8H_{2}O$
。②当溶液${pH}=4.5$时,$c{(Th^{4+})}=$
$4.0× 10^{-7}$
$mol/L$,此时完全转化为氢氧化钍沉淀。(5)以${BaSO_{4}}$为载体形成共沉淀,目的是去除杂质
硫酸镭
。
答案:
2.(14分)
(1)b
(2)$ + 6\ U_{3}O_{8} + 6NaOH + O_{2}\xlongequal{\triangle}3Na_{2}U_{2}O_{7} + 3H_{2}O$
(3)$Na_{3}PO_{4}$热分解
(4)①$2Ce(OH)_{4} + 8H^{+} + 2Cl^{-}\longrightarrow 2Ce^{3+} + Cl_{2}\uparrow + 8H_{2}O$
②$4.0× 10^{-7}$
(5)硫酸镭
【解析】以独居石为原料制备$CeCl_{3} · nH_{2}O$的工艺流程
(1)热分解阶段氧气参与部分反应,降低压强,分解速率减小,a错误;反应时间越长,$NaOH$浓度越小,分解速率越小,c错误;提高搅拌速度,分解速率增大,d错误。
(3)滤液中含有$NaOH$,可用于热分解阶段循环使用。
(4)②$pH = 4.5$时,$c(OH^{-}) = 10^{-9.5}\ mol/L$,根据$K_{sp}[Th(OH)_{4}] = 4.0×$ $10^{-45}$可算出$c(Th^{4+}) = 4.0× 10^{-7}\ mol/L$。
(5)结合独居石成分和工艺流程可知共沉淀时只有镭杂质未除去,因此共沉淀的目的是除去硫酸镭杂质。
(1)b
(2)$ + 6\ U_{3}O_{8} + 6NaOH + O_{2}\xlongequal{\triangle}3Na_{2}U_{2}O_{7} + 3H_{2}O$
(3)$Na_{3}PO_{4}$热分解
(4)①$2Ce(OH)_{4} + 8H^{+} + 2Cl^{-}\longrightarrow 2Ce^{3+} + Cl_{2}\uparrow + 8H_{2}O$
②$4.0× 10^{-7}$
(5)硫酸镭
【解析】以独居石为原料制备$CeCl_{3} · nH_{2}O$的工艺流程
(1)热分解阶段氧气参与部分反应,降低压强,分解速率减小,a错误;反应时间越长,$NaOH$浓度越小,分解速率越小,c错误;提高搅拌速度,分解速率增大,d错误。
(3)滤液中含有$NaOH$,可用于热分解阶段循环使用。
(4)②$pH = 4.5$时,$c(OH^{-}) = 10^{-9.5}\ mol/L$,根据$K_{sp}[Th(OH)_{4}] = 4.0×$ $10^{-45}$可算出$c(Th^{4+}) = 4.0× 10^{-7}\ mol/L$。
(5)结合独居石成分和工艺流程可知共沉淀时只有镭杂质未除去,因此共沉淀的目的是除去硫酸镭杂质。
查看更多完整答案,请扫码查看


