2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第23页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
1.(2025·山东卷,4分,不定项)钢渣中富含${CaO}$、${SiO_{2}}$、${FeO}$、${Fe_{2}O_{3}}$等氧化物,实验室利用酸碱协同法分离钢渣中的${Ca}$、${Si}$、${Fe}$元素,流程如下。
已知:${Fe_{2}(C_{2}O_{4})_{3}}$能溶于水;$K_{sp}{(CaC_{2}O_{4})}=2.3× 10^{-9}$,$K_{sp}{(FeC_{2}O_{4})}=3.2× 10^{-7}$。下列说法错误的是 (
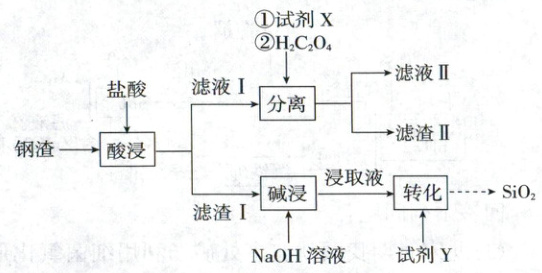
A.试剂X可选用${Fe}$粉
B.试剂Y可选用盐酸
C.“分离”后${Fe}$元素主要存在于滤液Ⅱ中
D.“酸浸”后滤液Ⅰ的${pH}$过小会导致滤渣Ⅱ质量减少
已知:${Fe_{2}(C_{2}O_{4})_{3}}$能溶于水;$K_{sp}{(CaC_{2}O_{4})}=2.3× 10^{-9}$,$K_{sp}{(FeC_{2}O_{4})}=3.2× 10^{-7}$。下列说法错误的是 (
A
)
A.试剂X可选用${Fe}$粉
B.试剂Y可选用盐酸
C.“分离”后${Fe}$元素主要存在于滤液Ⅱ中
D.“酸浸”后滤液Ⅰ的${pH}$过小会导致滤渣Ⅱ质量减少
答案:
1.A钢渣中元素的分离工艺
【流程分析】
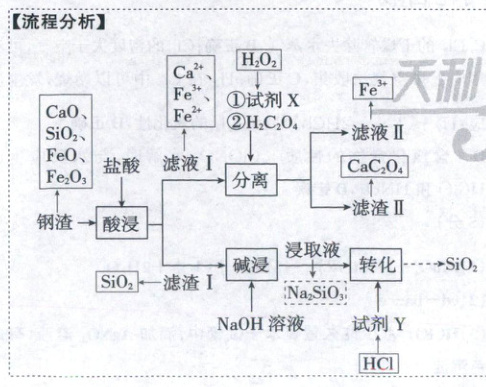
滤液I中含有$\mathrm{Ca^{2+}}$、$\mathrm{Fe^{2+}}$、$\mathrm{Fe^{3+}}$,加入$\mathrm{H_2C_2O_4}$沉淀$\mathrm{Ca^{2+}}$时,为防止$\mathrm{Fe^{2+}}$沉淀,应将$\mathrm{Fe^{2+}}$转化为$\mathrm{Fe^{3+}}$[$\mathrm{Fe_2(C_2O_4)_3}$能溶于水],因此X为氧化剂,可选择$\mathrm{H_2O_2}$,$\mathrm{Fe}$粉会将$\mathrm{Fe^{3+}}$转化为$\mathrm{Fe^{2+}}$,A错误;浸取液中含有$\mathrm{Na_2SiO_3}$,且最后生成$\mathrm{SiO_2}$,那么加入试剂Y形成$\mathrm{H_2SiO_3}$沉淀,Y可选用盐酸,B正确;分离后的滤液II主要含有$\mathrm{Fe^{3+}}$,C正确;“酸浸”后若滤液I的pH过小,$\mathrm{C_2O_4^{2-}}$的浓度会较小,则不利于$\mathrm{Ca^{2+}}$沉淀,因此滤渣II的质量会减少,D正确。
1.A钢渣中元素的分离工艺
【流程分析】

滤液I中含有$\mathrm{Ca^{2+}}$、$\mathrm{Fe^{2+}}$、$\mathrm{Fe^{3+}}$,加入$\mathrm{H_2C_2O_4}$沉淀$\mathrm{Ca^{2+}}$时,为防止$\mathrm{Fe^{2+}}$沉淀,应将$\mathrm{Fe^{2+}}$转化为$\mathrm{Fe^{3+}}$[$\mathrm{Fe_2(C_2O_4)_3}$能溶于水],因此X为氧化剂,可选择$\mathrm{H_2O_2}$,$\mathrm{Fe}$粉会将$\mathrm{Fe^{3+}}$转化为$\mathrm{Fe^{2+}}$,A错误;浸取液中含有$\mathrm{Na_2SiO_3}$,且最后生成$\mathrm{SiO_2}$,那么加入试剂Y形成$\mathrm{H_2SiO_3}$沉淀,Y可选用盐酸,B正确;分离后的滤液II主要含有$\mathrm{Fe^{3+}}$,C正确;“酸浸”后若滤液I的pH过小,$\mathrm{C_2O_4^{2-}}$的浓度会较小,则不利于$\mathrm{Ca^{2+}}$沉淀,因此滤渣II的质量会减少,D正确。
2.(2024·江西卷,3分)从CPU针脚(含有铜、镍和钴等金属)中回收金的实验步骤如图。下列说法错误的是 (
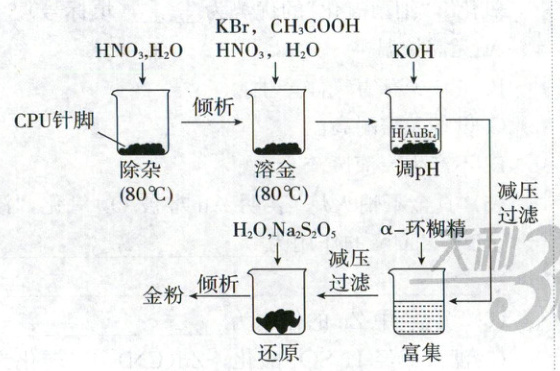
A.将CPU针脚粉碎可加速溶解
B.除杂和溶金步骤需在通风橱中进行
C.富集后,${K[AuBr_{4}]}$主要存在于滤液中
D.还原步骤中有${SO^{2-}_{4}}$生成
C
)
A.将CPU针脚粉碎可加速溶解
B.除杂和溶金步骤需在通风橱中进行
C.富集后,${K[AuBr_{4}]}$主要存在于滤液中
D.还原步骤中有${SO^{2-}_{4}}$生成
答案:
2.C从CPU针脚中回收金的实验 将CPU针脚粉碎可增大反应物的接触面积,加速溶解,A正确;除杂和溶金步骤中均涉及硝酸参与的氧化还原反应,有氮氧化物生成,需在通风橱中进行,B正确;第二次减压过滤后得到的物质经还原、倾析后得到金粉,则富集后$\mathrm{K[AuBr_4]}$主要存在于滤渣中,C错误;还原步骤中$\mathrm{Na_2S_2O_3}$作还原剂,S元素化合价由+4价升高到+6价,则还原步骤中有$\mathrm{SO_4^{2-}}$生成,D正确。
3.(2023·福建卷,4分)从炼钢粉尘(主要含${Fe_{3}O_{4}}$、${Fe_{2}O_{3}}$和${ZnO}$)中提取锌的流程如下:
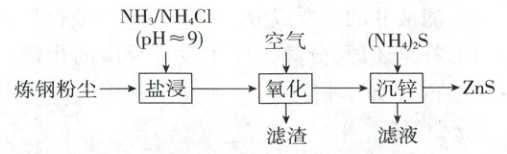
“盐浸”过程${ZnO}$转化为${[Zn(NH_{3})_{4}]^{2+}}$,并有少量${Fe^{2+}}$和${Fe^{3+}}$浸出。下列说法错误的是 (
A.“盐浸”过程若浸液${pH}$下降,需补充${NH_{3}}$
B.“滤渣”的主要成分为${Fe(OH)_{3}}$
C.“沉锌”过程发生反应${[Zn(NH_{3})_{4}]^{2+} + 4H_{2}O + S^{2-}\xlongequal{}ZnS\downarrow + 4NH_{3}· H_{2}O}$
D.应合理控制${(NH_{4})_{2}S}$用量,以便滤液循环使用

“盐浸”过程${ZnO}$转化为${[Zn(NH_{3})_{4}]^{2+}}$,并有少量${Fe^{2+}}$和${Fe^{3+}}$浸出。下列说法错误的是 (
B
)A.“盐浸”过程若浸液${pH}$下降,需补充${NH_{3}}$
B.“滤渣”的主要成分为${Fe(OH)_{3}}$
C.“沉锌”过程发生反应${[Zn(NH_{3})_{4}]^{2+} + 4H_{2}O + S^{2-}\xlongequal{}ZnS\downarrow + 4NH_{3}· H_{2}O}$
D.应合理控制${(NH_{4})_{2}S}$用量,以便滤液循环使用
答案:
3.B锌的提取工艺流程
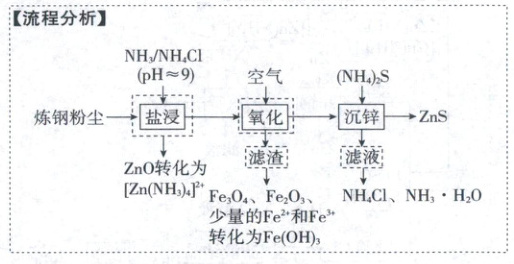
“盐浸”过程中消耗氨气,浸液pH下降,需补充$\mathrm{NH_3}$,A正确;由“盐浸”过程有少量$\mathrm{Fe^{2+}}$和$\mathrm{Fe^{3+}}$浸出可知,“滤渣”的主要成分为$\mathrm{Fe_3O_4}$和$\mathrm{Fe_2O_3}$,只含少量的$\mathrm{Fe(OH)_3}$,B错误;“沉锌”过程发生反应$\mathrm{[Zn(NH_3)_4]^{2+} + 4H_2O + S^{2-} = ZnS \downarrow + 4NH_3 · H_2O}$,C正确;应合理控制$\mathrm{(NH_4)_2S}$用量,使滤液中的主要成分为$\mathrm{NH_4Cl}$和$\mathrm{NH_3 · H_2O}$,以便滤液循环使用,D正确。
3.B锌的提取工艺流程

“盐浸”过程中消耗氨气,浸液pH下降,需补充$\mathrm{NH_3}$,A正确;由“盐浸”过程有少量$\mathrm{Fe^{2+}}$和$\mathrm{Fe^{3+}}$浸出可知,“滤渣”的主要成分为$\mathrm{Fe_3O_4}$和$\mathrm{Fe_2O_3}$,只含少量的$\mathrm{Fe(OH)_3}$,B错误;“沉锌”过程发生反应$\mathrm{[Zn(NH_3)_4]^{2+} + 4H_2O + S^{2-} = ZnS \downarrow + 4NH_3 · H_2O}$,C正确;应合理控制$\mathrm{(NH_4)_2S}$用量,使滤液中的主要成分为$\mathrm{NH_4Cl}$和$\mathrm{NH_3 · H_2O}$,以便滤液循环使用,D正确。
4.【生产环保】(2023·湖南卷,3分)处理某铜冶金污水(含${Cu^{2+}}$、${Fe^{3+}}$、${Zn^{2+}}$、${Al^{3+}}$)的部分流程如下:
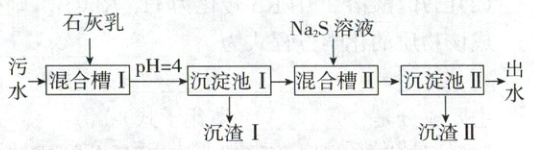
已知:①溶液中金属离子开始沉淀和完全沉淀的${pH}$如表所示:

②$K_{sp}{(CuS)}=6.4× 10^{-36}$,$K_{sp}{(ZnS)}=1.6× 10^{-24}$。
下列说法错误的是 (
A.“沉渣Ⅰ”中含有${Fe(OH)_{3}}$和${Al(OH)_{3}}$
B.${Na_{2}S}$溶液呈碱性,其主要原因是${S^{2-} + H_{2}O⇌ HS^{-} + OH^{-}}$
C.“沉淀池Ⅱ”中,当${Cu^{2+}}$和${Zn^{2+}}$完全沉淀时,溶液中$\dfrac{c{(Cu^{2+})}}{c{(Zn^{2+})}}=4.0× 10^{-12}$
D.“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水

已知:①溶液中金属离子开始沉淀和完全沉淀的${pH}$如表所示:

②$K_{sp}{(CuS)}=6.4× 10^{-36}$,$K_{sp}{(ZnS)}=1.6× 10^{-24}$。
下列说法错误的是 (
D
)A.“沉渣Ⅰ”中含有${Fe(OH)_{3}}$和${Al(OH)_{3}}$
B.${Na_{2}S}$溶液呈碱性,其主要原因是${S^{2-} + H_{2}O⇌ HS^{-} + OH^{-}}$
C.“沉淀池Ⅱ”中,当${Cu^{2+}}$和${Zn^{2+}}$完全沉淀时,溶液中$\dfrac{c{(Cu^{2+})}}{c{(Zn^{2+})}}=4.0× 10^{-12}$
D.“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水
答案:
4.D工艺流程 调pH = 4后,根据表中数据可知,$\mathrm{Fe^{3+}}$会完全沉淀,$\mathrm{Al^{3+}}$会部分沉淀,则沉渣I中含有$\mathrm{Fe(OH)_3}$和$\mathrm{Al(OH)_3}$,A项正确;$\mathrm{Na_2S}$溶液中$\mathrm{S^{2-}}$水解使得溶液呈碱性,水解方程式为$\mathrm{S^{2-} + H_2O \rightleftharpoons HS^- + OH^-}$,B项正确;“沉淀池II”中,当$\mathrm{Cu^{2+}}$和$\mathrm{Zn^{2+}}$完全沉淀时,溶液中$\frac{c(\mathrm{Cu^{2+}})}{c(\mathrm{Zn^{2+}})} = \frac{c(\mathrm{Cu^{2+}}) · c(\mathrm{S^{2-}})}{c(\mathrm{Zn^{2+}}) · c(\mathrm{S^{2-}})} = \frac{K_{sp}(\mathrm{CuS})}{K_{sp}(\mathrm{ZnS})} = 4.0 × 10^{-12}$,C项正确;阴离子交换树脂在溶液中能以氢氧根离子交换溶液中的阴离子,从而达到处理水中阴离子的目的,但“出水”中还含有$\mathrm{Al^{3+}}$等阳离子,故不可用作工业冷却循环用水,D项错误。
查看更多完整答案,请扫码查看


