2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第74页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
5. (2024·湖南卷,3分)恒压下,向某密闭容器中充入一定量的${CH_{3}OH(g)}$和${CO(g)}$,发生如下反应:
主反应:${CH_{3}OH(g) + CO(g)\xlongequal{}CH_{3}COOH(g)}$ $\Delta H_{1}$
副反应:${CH_{3}OH(g) + CH_{3}COOH(g)\xlongequal{}CH_{3}COOCH_{3}(g) + H_{2}O(g)}$ $\Delta H_{2}$
在不同温度下,反应达到平衡时,测得两种含碳产物的分布分数$\delta\left \lbrack \delta{(CH_{3}COOH)}=\dfrac{n{(CH_{3}COOH)}}{n{(CH_{3}COOH)} + n{(CH_{3}COOCH_{3})}}\right \rbrack$随投料比$x$(物质的量之比)的变化关系如图所示,下列说法正确的是 (
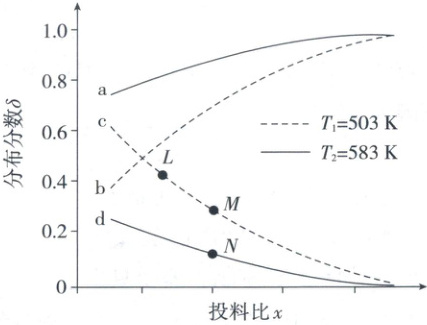
A.投料比$x$代表$\dfrac{n{(CH_{3}OH)}}{n{(CO)}}$
B.曲线c代表乙酸的分布分数
C.$\Delta H_{1}<0$,$\Delta H_{2}>0$
D.$L$、$M$、$N$三点的平衡常数:$K(L)=K(M)>K(N)$
主反应:${CH_{3}OH(g) + CO(g)\xlongequal{}CH_{3}COOH(g)}$ $\Delta H_{1}$
副反应:${CH_{3}OH(g) + CH_{3}COOH(g)\xlongequal{}CH_{3}COOCH_{3}(g) + H_{2}O(g)}$ $\Delta H_{2}$
在不同温度下,反应达到平衡时,测得两种含碳产物的分布分数$\delta\left \lbrack \delta{(CH_{3}COOH)}=\dfrac{n{(CH_{3}COOH)}}{n{(CH_{3}COOH)} + n{(CH_{3}COOCH_{3})}}\right \rbrack$随投料比$x$(物质的量之比)的变化关系如图所示,下列说法正确的是 (
D
)
A.投料比$x$代表$\dfrac{n{(CH_{3}OH)}}{n{(CO)}}$
B.曲线c代表乙酸的分布分数
C.$\Delta H_{1}<0$,$\Delta H_{2}>0$
D.$L$、$M$、$N$三点的平衡常数:$K(L)=K(M)>K(N)$
答案:
5.D 平衡图像 生成$CH_{3}COOH$的反应为主反应,生成$CH_{3}COOCH_{3}$的反应为副反应,所以曲线a、b为$CH_{3}COOH$分布分数曲线,曲线c、d为$CH_{3}COOCH_{3}$分布分数曲线。增大投料比$x$,$CH_{3}COOH$占比增大,所以投料比$x$代表$\frac{n(CO)}{n(CH_{3}OH)}$, A错误;曲线c代表503K时$CH_{3}COOCH_{3}$分布分数
, B错误;升高温度,$CH_{3}COOH$占比增大,$CH_{3}COOCH_{3}$占比减小,说明升温副反应平衡逆向移动,$\Delta H_{2}<0$,C错误;L、M点温度相等,K相等, N点温度更高,由于$\Delta H_{2}<0$,N点平衡常数更小,$K(L)=K(M)>K(N)$,D正确。
, B错误;升高温度,$CH_{3}COOH$占比增大,$CH_{3}COOCH_{3}$占比减小,说明升温副反应平衡逆向移动,$\Delta H_{2}<0$,C错误;L、M点温度相等,K相等, N点温度更高,由于$\Delta H_{2}<0$,N点平衡常数更小,$K(L)=K(M)>K(N)$,D正确。
6. (2024·山东卷,4分,不定项)逆水气变换反应:${CO_{2}(g) + H_{2}(g)⇌ CO(g) + H_{2}O(g)}$ $\Delta H>0$。一定压力下,按${CO_{2}}$,${H_{2}}$物质的量之比$n{(CO_{2})}:n{(H_{2})}=1:1$投料,$T_{1}$,$T_{2}$温度时反应物摩尔分数随时间变化关系如图所示。已知该反应的速率方程为$v=kc^{0.5}{(H_{2})}c{(CO_{2})}$,$T_{1}$,$T_{2}$温度时反应速率常数$k$分别为$k_{1}$,$k_{2}$。下列说法错误的是 (
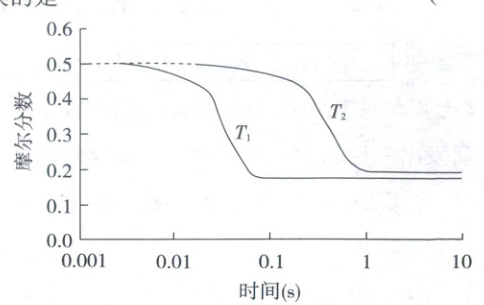
A.$k_{1}>k_{2}$
B.$T_{1}$,$T_{2}$温度下达平衡时反应速率的比值:$\dfrac{v(T_{1})}{v(T_{2})}<\dfrac{k_{1}}{k_{2}}$
C.温度不变,仅改变体系初始压力,反应物摩尔分数随时间的变化曲线不变
D.$T_{2}$温度下,改变初始投料比例,可使平衡时各组分摩尔分数与$T_{1}$温度时相同
CD
)
A.$k_{1}>k_{2}$
B.$T_{1}$,$T_{2}$温度下达平衡时反应速率的比值:$\dfrac{v(T_{1})}{v(T_{2})}<\dfrac{k_{1}}{k_{2}}$
C.温度不变,仅改变体系初始压力,反应物摩尔分数随时间的变化曲线不变
D.$T_{2}$温度下,改变初始投料比例,可使平衡时各组分摩尔分数与$T_{1}$温度时相同
答案:
6.CD 化学反应速率与平衡 反应吸热,温度升高,平衡正向移动,平衡时反应物的摩尔分数较小,结合图像可知$T_{1}>T_{2}$,速率常数$k$与温度正相关,所以$k_{1}>k_{2}$,A正确;反应达平衡时,结合速率方程有$\frac{v(T_{1})}{v(T_{2})}=\frac{k_{1}c_{1}^{0.5}(H_{2})c_{1}(CO_{2})}{k_{2}c_{2}^{0.5}(H_{2})c_{2}(CO_{2})}$, 由图可知,平衡时$T_{1}$温度下反应物的浓度较小,所以$\frac{c_{1}^{0.5}(H_{2})c_{1}(CO_{2})}{c_{2}^{0.5}(H_{2})c_{2}(CO_{2})}<1$,可得$\frac{k_{1}c_{1}^{0.5}(H_{2})c_{1}(CO_{2})}{k_{2}c_{2}^{0.5}(H_{2})c_{2}(CO_{2})}<\frac{k_{1}}{k_{2}}$,即$\frac{v(T_{1})}{v(T_{2})}<\frac{k_{1}}{k_{2}}$,B项正确;温度不变,平衡常数不变,仅改变体系初始压力,由于反应为气体分子数不变的反应,所以平衡不移动,平衡时反应物的摩尔分数不变,但是改变压强,反应速率改变,反应物的摩尔分数随时间的变化曲线随之改变,C项错误;$CO_{2}$和$H_{2}$的物质的量投料比为1:1时,平衡时$CO_{2}$与$H_{2}$的摩尔分数相等,但改变初始投料比之后,平衡时$CO_{2}$与$H_{2}$的摩尔分数不再相等,D项错误。
由图可知,平衡时$T_{1}$温度下反应物的浓度较小,所以$\frac{c_{1}^{0.5}(H_{2})c_{1}(CO_{2})}{c_{2}^{0.5}(H_{2})c_{2}(CO_{2})}<1$,可得$\frac{k_{1}c_{1}^{0.5}(H_{2})c_{1}(CO_{2})}{k_{2}c_{2}^{0.5}(H_{2})c_{2}(CO_{2})}<\frac{k_{1}}{k_{2}}$,即$\frac{v(T_{1})}{v(T_{2})}<\frac{k_{1}}{k_{2}}$,B项正确;温度不变,平衡常数不变,仅改变体系初始压力,由于反应为气体分子数不变的反应,所以平衡不移动,平衡时反应物的摩尔分数不变,但是改变压强,反应速率改变,反应物的摩尔分数随时间的变化曲线随之改变,C项错误;$CO_{2}$和$H_{2}$的物质的量投料比为1:1时,平衡时$CO_{2}$与$H_{2}$的摩尔分数相等,但改变初始投料比之后,平衡时$CO_{2}$与$H_{2}$的摩尔分数不再相等,D项错误。
6.CD 化学反应速率与平衡 反应吸热,温度升高,平衡正向移动,平衡时反应物的摩尔分数较小,结合图像可知$T_{1}>T_{2}$,速率常数$k$与温度正相关,所以$k_{1}>k_{2}$,A正确;反应达平衡时,结合速率方程有$\frac{v(T_{1})}{v(T_{2})}=\frac{k_{1}c_{1}^{0.5}(H_{2})c_{1}(CO_{2})}{k_{2}c_{2}^{0.5}(H_{2})c_{2}(CO_{2})}$,
 由图可知,平衡时$T_{1}$温度下反应物的浓度较小,所以$\frac{c_{1}^{0.5}(H_{2})c_{1}(CO_{2})}{c_{2}^{0.5}(H_{2})c_{2}(CO_{2})}<1$,可得$\frac{k_{1}c_{1}^{0.5}(H_{2})c_{1}(CO_{2})}{k_{2}c_{2}^{0.5}(H_{2})c_{2}(CO_{2})}<\frac{k_{1}}{k_{2}}$,即$\frac{v(T_{1})}{v(T_{2})}<\frac{k_{1}}{k_{2}}$,B项正确;温度不变,平衡常数不变,仅改变体系初始压力,由于反应为气体分子数不变的反应,所以平衡不移动,平衡时反应物的摩尔分数不变,但是改变压强,反应速率改变,反应物的摩尔分数随时间的变化曲线随之改变,C项错误;$CO_{2}$和$H_{2}$的物质的量投料比为1:1时,平衡时$CO_{2}$与$H_{2}$的摩尔分数相等,但改变初始投料比之后,平衡时$CO_{2}$与$H_{2}$的摩尔分数不再相等,D项错误。
由图可知,平衡时$T_{1}$温度下反应物的浓度较小,所以$\frac{c_{1}^{0.5}(H_{2})c_{1}(CO_{2})}{c_{2}^{0.5}(H_{2})c_{2}(CO_{2})}<1$,可得$\frac{k_{1}c_{1}^{0.5}(H_{2})c_{1}(CO_{2})}{k_{2}c_{2}^{0.5}(H_{2})c_{2}(CO_{2})}<\frac{k_{1}}{k_{2}}$,即$\frac{v(T_{1})}{v(T_{2})}<\frac{k_{1}}{k_{2}}$,B项正确;温度不变,平衡常数不变,仅改变体系初始压力,由于反应为气体分子数不变的反应,所以平衡不移动,平衡时反应物的摩尔分数不变,但是改变压强,反应速率改变,反应物的摩尔分数随时间的变化曲线随之改变,C项错误;$CO_{2}$和$H_{2}$的物质的量投料比为1:1时,平衡时$CO_{2}$与$H_{2}$的摩尔分数相等,但改变初始投料比之后,平衡时$CO_{2}$与$H_{2}$的摩尔分数不再相等,D项错误。 7. (2021·江苏卷,3分)${NH_{3}}$与${O_{2}}$作用分别生成${N_{2}}$、${NO}$、${N_{2}O}$的反应均为放热反应。工业尾气中的${NH_{3}}$可通过催化氧化为${N_{2}}$除去。将一定比例${NH_{3}}$、${O_{2}}$和${N_{2}}$的混合气体以一定流速通过装有催化剂的反应管,${NH_{3}}$的转化率、${N_{2}}$的选择性$\left \lbrack \dfrac{2n_{生成}{(N_{2})}}{n_{总转化}{(NH_{3})}}× 100\%\right \rbrack$与温度的关系如图所示。下列说法正确的是 (
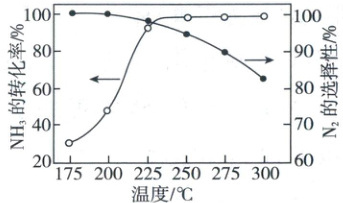
A.其他条件不变,升高温度,${NH_{3}}$的平衡转化率增大
B.其他条件不变,在$175\sim 300\ ^{\circ}C$范围,随着温度的升高,出口处氮气、氮氧化物的量均不断增大
C.催化氧化除去尾气中的${NH_{3}}$应选择反应温度高于$250\ ^{\circ}C$
D.高效除去尾气中的${NH_{3}}$,需研发低温下${NH_{3}}$转化率高和${N_{2}}$选择性高的催化剂
D
)
A.其他条件不变,升高温度,${NH_{3}}$的平衡转化率增大
B.其他条件不变,在$175\sim 300\ ^{\circ}C$范围,随着温度的升高,出口处氮气、氮氧化物的量均不断增大
C.催化氧化除去尾气中的${NH_{3}}$应选择反应温度高于$250\ ^{\circ}C$
D.高效除去尾气中的${NH_{3}}$,需研发低温下${NH_{3}}$转化率高和${N_{2}}$选择性高的催化剂
答案:
7.D 化学平衡 由于氨气与氧气的反应是放热反应,所以其他条件不变时升高温度平衡逆向移动,$NH_{3}$的平衡转化率减小,A错误;由图可知,温度升高$NH_{3}$的转化率升高,$N_{2}$的选择性降低,所以出口处氮气的量不断减小,氮氧化物的量不断增大,B错误;由图像可知除去$NH_{3}$应选择反应温度在$225^{\circ}C$左右,C错误;氮氧化物对环境有污染,氨气与氧气的反应是放热反应,所以可选择低温下$NH_{3}$转化率高和$N_{2}$选择性高的催化剂,D正确。
查看更多完整答案,请扫码查看


