2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第24页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
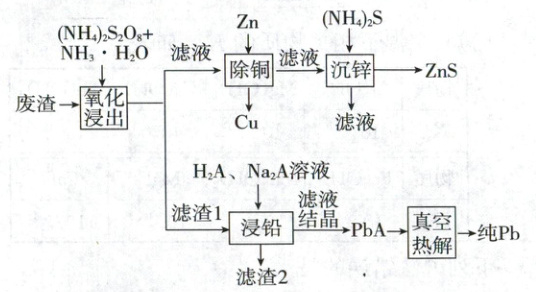
5.【生产环保】(2025·辽吉黑内蒙古卷,14分)某工厂采用如下工艺回收废渣(含有${ZnS}$、${PbSO_{4}}$、${FeS}$和${CuCl}$)中的${Zn}$、${Pb}$元素。
已知:①“氧化浸出”时,${PbSO_{4}}$不发生变化,${ZnS}$转变为${[Zn(NH_{3})_{4}]^{2+}}$;
②$K_{sp}{[Pb(OH)_{2}]}=10^{-14.8}$;
③酒石酸(记作${H_{2}A}$)结构简式为${HOOC(CHOH)_{2}COOH}$。
回答下列问题:
(1)${H_{2}A}$分子中手性碳原子数目为
(2)“氧化浸出”时,过二硫酸根${(S_{2}O^{2-}_{8})}$转变为
(3)“氧化浸出”时,浸出率随温度升高先增大后减小的原因为
(4)“除铜”步骤中发生反应的离子方程式为
(5)滤渣2中的金属元素为
(6)“浸铅”步骤,${PbSO_{4}}$和${Na_{2}A}$反应生成${PbA}$。${PbA}$产率随体系${pH}$升高先增大的原因为
(7)$290\ ^{\circ}C$“真空热解”生成2种气态氧化物,该反应的化学方程式为
已知:①“氧化浸出”时,${PbSO_{4}}$不发生变化,${ZnS}$转变为${[Zn(NH_{3})_{4}]^{2+}}$;
②$K_{sp}{[Pb(OH)_{2}]}=10^{-14.8}$;
③酒石酸(记作${H_{2}A}$)结构简式为${HOOC(CHOH)_{2}COOH}$。
回答下列问题:
(1)${H_{2}A}$分子中手性碳原子数目为
2
。(2)“氧化浸出”时,过二硫酸根${(S_{2}O^{2-}_{8})}$转变为
SO_4^{2-}
(填离子符号)。(3)“氧化浸出”时,浸出率随温度升高先增大后减小的原因为
温度较低时,随温度升高,反应速率加快,浸出率增大;温度较高时,升高温度,NH_3·H_2O挥发、(NH_4)_2S_2O_8分解,浓度降低,反应速率下降,浸出率减小
。(4)“除铜”步骤中发生反应的离子方程式为
Zn + [Cu(NH_3)_4]^{2+} = Cu + [Zn(NH_3)_4]^{2+}
。(5)滤渣2中的金属元素为
Fe
(填元素符号)。(6)“浸铅”步骤,${PbSO_{4}}$和${Na_{2}A}$反应生成${PbA}$。${PbA}$产率随体系${pH}$升高先增大的原因为
随体系pH升高,H_2A电离平衡右移,A^{2-}水解平衡左移,c(A^{2-})逐渐增大
,${pH}$过高可能生成Pb(OH)_2
(填化学式)。(7)$290\ ^{\circ}C$“真空热解”生成2种气态氧化物,该反应的化学方程式为
Pb[OOC(CHOH)_2COO] \xlongequal{290 ^{\circ}C,真空} Pb + 4CO ↑ + 2H_2O ↑
。
答案:
5.(14分)
(1)2
(2)$\mathrm{SO_4^{2-}}$
(3)温度较低时,随温度升高,反应速率加快,浸出率增大;温度较高时,升高温度,$\mathrm{NH_3 · H_2O}$挥发、$\mathrm{(NH_4)_2S_2O_8}$分解,浓度降低,反应速率下降,浸出率减小
(4)$\mathrm{Zn + [Cu(NH_3)_4]^{2+} = Cu + [Zn(NH_3)_4]^{2+}}$
(5)$\mathrm{Fe}$
(6)随体系pH升高,$\mathrm{H_2A}$电离平衡右移,$\mathrm{A^{2-}}$水解平衡左移,$c(\mathrm{A^{2-}})$逐渐增大;$\mathrm{Pb(OH)_2}$
(7)$\mathrm{Pb[OOC(CHOH)_2COO] \xlongequal{290 ^{\circ}C,真空} Pb + 4CO \uparrow + 2H_2O \uparrow}$(或$\mathrm{PbA \xlongequal{290 ^{\circ}C,真空} Pb + 4CO \uparrow + 2H_2O \uparrow}$)

【解析】回收废渣中的$\mathrm{Zn}$、$\mathrm{Pb}$元素的工艺流程
(1)酒石酸中与羟基相连的2个碳原子为手性碳原子。
(2)过二硫酸根中含有2个 -1价O,具有强氧化性,“氧化浸出”时,过二硫酸根被还原为$SO_{4}^{2 - }$。
(4)“除铜”步骤中Zn与$[Cu(NH_{3})_{4}]^{2 + }$发生置换反应生成Cu和$[Zn(NH_{3})_{4}]^{2 + }$,反应的离子方程式为$Zn + [Cu(NH_{3})_{4}]^{2 + } = Cu + [Zn(NH_{3})_{4}]^{2 + }$。
(5)滤渣2中的金属元素为Fe。
(6)随体系pH升高,$c(A^{2 + })$逐渐增大,PbA的产率先增大,但pH过高可能会生成$Pb(OH)_{2}$导致PbA的产率减小。
(7)结合$A^{2 - }$的结构可知,290℃“真空热解”生成的2种气态氧化物为CO和$H_{2}O$,反应的化学方程式为$Pb[OOC(CHOH)_{2}COO]\xlongequal[真空]{290^{\circ}C}Pb + 4CO\uparrow + 2H_{2}O\uparrow$。
5.(14分)
(1)2
(2)$\mathrm{SO_4^{2-}}$
(3)温度较低时,随温度升高,反应速率加快,浸出率增大;温度较高时,升高温度,$\mathrm{NH_3 · H_2O}$挥发、$\mathrm{(NH_4)_2S_2O_8}$分解,浓度降低,反应速率下降,浸出率减小
(4)$\mathrm{Zn + [Cu(NH_3)_4]^{2+} = Cu + [Zn(NH_3)_4]^{2+}}$
(5)$\mathrm{Fe}$
(6)随体系pH升高,$\mathrm{H_2A}$电离平衡右移,$\mathrm{A^{2-}}$水解平衡左移,$c(\mathrm{A^{2-}})$逐渐增大;$\mathrm{Pb(OH)_2}$
(7)$\mathrm{Pb[OOC(CHOH)_2COO] \xlongequal{290 ^{\circ}C,真空} Pb + 4CO \uparrow + 2H_2O \uparrow}$(或$\mathrm{PbA \xlongequal{290 ^{\circ}C,真空} Pb + 4CO \uparrow + 2H_2O \uparrow}$)

【解析】回收废渣中的$\mathrm{Zn}$、$\mathrm{Pb}$元素的工艺流程
(1)酒石酸中与羟基相连的2个碳原子为手性碳原子。
(2)过二硫酸根中含有2个 -1价O,具有强氧化性,“氧化浸出”时,过二硫酸根被还原为$SO_{4}^{2 - }$。
(4)“除铜”步骤中Zn与$[Cu(NH_{3})_{4}]^{2 + }$发生置换反应生成Cu和$[Zn(NH_{3})_{4}]^{2 + }$,反应的离子方程式为$Zn + [Cu(NH_{3})_{4}]^{2 + } = Cu + [Zn(NH_{3})_{4}]^{2 + }$。
(5)滤渣2中的金属元素为Fe。
(6)随体系pH升高,$c(A^{2 + })$逐渐增大,PbA的产率先增大,但pH过高可能会生成$Pb(OH)_{2}$导致PbA的产率减小。
(7)结合$A^{2 - }$的结构可知,290℃“真空热解”生成的2种气态氧化物为CO和$H_{2}O$,反应的化学方程式为$Pb[OOC(CHOH)_{2}COO]\xlongequal[真空]{290^{\circ}C}Pb + 4CO\uparrow + 2H_{2}O\uparrow$。
6.(2024·山东卷,12分)以铅精矿(含${PbS}$,${Ag_{2}S}$等)为主要原料提取金属${Pb}$和${Ag}$的工艺流程如下:
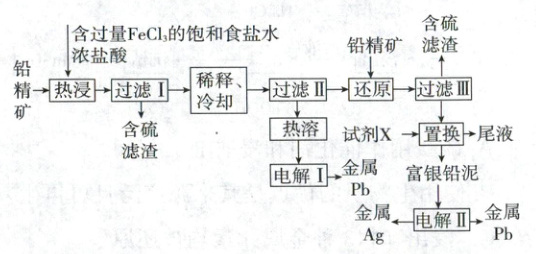
回答下列问题:
(1)“热浸”时,难溶的${PbS}$和${Ag_{2}S}$转化为${[PbCl_{4}]^{2-}}$和${[AgCl_{2}]^{-}}$及单质硫。溶解等物质的量的${PbS}$和${Ag_{2}S}$时,消耗${Fe^{3+}}$物质的量之比为
(2)将“过滤Ⅱ”得到的${PbCl_{2}}$沉淀反复用饱和食盐水热溶,电解所得溶液可制备金属${Pb}$。“电解Ⅰ”阳极产物用尾液吸收后在工艺中循环使用,利用该吸收液的操作单元为
(3)“还原”中加入铅精矿的目的是
(4)“置换”中可选用的试剂X为
A. ${Al}$
B. ${Zn}$
C. ${Pb}$
D. ${Ag}$
“置换”反应的离子方程式为
(5)“电解Ⅱ”中将富银铅泥制成电极板,用作

回答下列问题:
(1)“热浸”时,难溶的${PbS}$和${Ag_{2}S}$转化为${[PbCl_{4}]^{2-}}$和${[AgCl_{2}]^{-}}$及单质硫。溶解等物质的量的${PbS}$和${Ag_{2}S}$时,消耗${Fe^{3+}}$物质的量之比为
2:1
;溶液中盐酸浓度不宜过大,除防止“热浸”时${HCl}$挥发外,另一目的是防止产生PbCl_2
(填化学式)。(2)将“过滤Ⅱ”得到的${PbCl_{2}}$沉淀反复用饱和食盐水热溶,电解所得溶液可制备金属${Pb}$。“电解Ⅰ”阳极产物用尾液吸收后在工艺中循环使用,利用该吸收液的操作单元为
热浸
。(3)“还原”中加入铅精矿的目的是
将Ag^+还原为Ag
。(4)“置换”中可选用的试剂X为
B
(填标号);A. ${Al}$
B. ${Zn}$
C. ${Pb}$
D. ${Ag}$
“置换”反应的离子方程式为
2Ag^+ + Zn = 2Ag + Zn^{2+}
。(5)“电解Ⅱ”中将富银铅泥制成电极板,用作
阳极
(填“阴极”或“阳极”)。
答案:
6.(12分)
(1) 2:1;$\mathrm{PbCl_2}$
(2) 热浸(或“热浸”工序)
(3) 将$\mathrm{Ag^+}$还原为$\mathrm{Ag}$
(4) B;$\mathrm{2Ag^+ + Zn = 2Ag + Zn^{2+}}$
(5) 阳极
(1) 2:1;$\mathrm{PbCl_2}$
(2) 热浸(或“热浸”工序)
(3) 将$\mathrm{Ag^+}$还原为$\mathrm{Ag}$
(4) B;$\mathrm{2Ag^+ + Zn = 2Ag + Zn^{2+}}$
(5) 阳极
查看更多完整答案,请扫码查看


