2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第17页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
1. (2025·云南卷,3分)下列化学方程式错误的是(
A.煤制水煤气:${C + H_{2}O(g)\xlongequal{高温}CO + H_{2}}$
B.${Na_{2}O_{2}}$供氧:${2Na_{2}O_{2} + 2CO_{2}\xlongequal{}2Na_{2}CO_{3} + O_{2}}$
C.覆铜板制作印刷电路板:${2FeCl_{3} + 3Cu\xlongequal{}3CuCl_{2} + 2Fe}$
D.铅酸蓄电池放电:${Pb + PbO_{2} + 2H_{2}SO_{4}\xlongequal{}2PbSO_{4} + 2H_{2}O}$
C
)A.煤制水煤气:${C + H_{2}O(g)\xlongequal{高温}CO + H_{2}}$
B.${Na_{2}O_{2}}$供氧:${2Na_{2}O_{2} + 2CO_{2}\xlongequal{}2Na_{2}CO_{3} + O_{2}}$
C.覆铜板制作印刷电路板:${2FeCl_{3} + 3Cu\xlongequal{}3CuCl_{2} + 2Fe}$
D.铅酸蓄电池放电:${Pb + PbO_{2} + 2H_{2}SO_{4}\xlongequal{}2PbSO_{4} + 2H_{2}O}$
答案:
1.C 化学方程式的正误判断 Cu的金属性弱于Fe,不能置换出Fe,覆铜板制作印刷电路板过程的方程式为Cu + 2FeCl₃=CuCl₂ + 2FeCl₂,C错误。
2. 【回归教材】(2024·新课标卷,6分)实验室中利用下图装置验证铁与水蒸气的反应。下列说法错误的是(
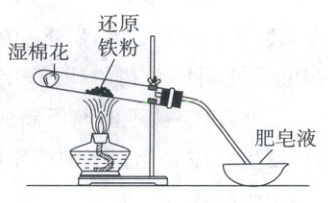
A.反应为${3Fe(s) + 4H_{2}O(g)\xlongequal{高温}Fe_{3}O_{4}(s) + 4H_{2}(g)}$
B.酒精灯移至湿棉花下方实验效果更佳
C.用火柴点燃肥皂泡检验生成的氢气
D.使用硬质玻璃试管盛装还原铁粉
B
)
A.反应为${3Fe(s) + 4H_{2}O(g)\xlongequal{高温}Fe_{3}O_{4}(s) + 4H_{2}(g)}$
B.酒精灯移至湿棉花下方实验效果更佳
C.用火柴点燃肥皂泡检验生成的氢气
D.使用硬质玻璃试管盛装还原铁粉
答案:
2.B 铁与水蒸气反应的实验 铁与水蒸气的反应为$3Fe + 4H₂O(g)\stackrel{高温}{=}Fe₃O₄ + 4H₂,$A正确;如果把酒精灯移到湿棉花下方,铁粉处达不到反应所需的温度,B错误;用火柴点燃肥皂泡,通过是否产生爆鸣声可检验氢气,C正确;普通玻璃高温会软化,因此应使用硬质玻璃试管盛放还原铁粉,D正确。
3. (2023·江苏卷,3分)室温下,探究$0.1\ mol/L\ {FeSO_{4}}$溶液的性质,下列实验方案能达到探究目的的是(
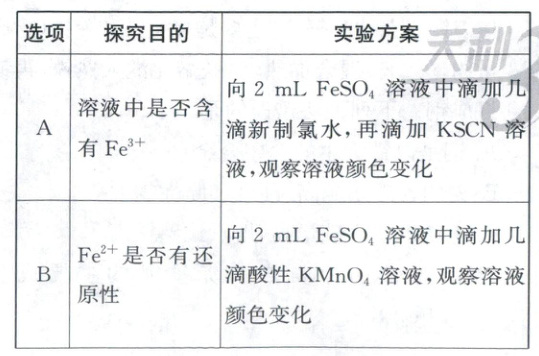
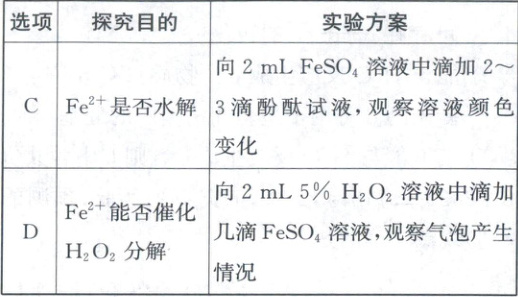
B
)

答案:
3.B 实验设计及评价 先滴加新制氯水,可氧化亚铁离子,应取少量待测液直接滴加KSCN溶液检验是否含有铁离子,A错误;亚铁离子被酸性高锰酸钾溶液氧化,紫色褪去,可知Fe²⁺有还原性,B正确;亚铁离子水解显酸性,滴加酚酞无现象,不能检验Fe²⁺是否水解,C错误;选项中未设置对照组,仅从滴加几滴FeSO₄溶液后“气泡产生情况”无法得知H₂O₂的分解是否被催化,D错误。
4. (2023·6月浙江卷,3分)探究铁及其化合物的性质,下列方案设计、现象和结论都正确的是(
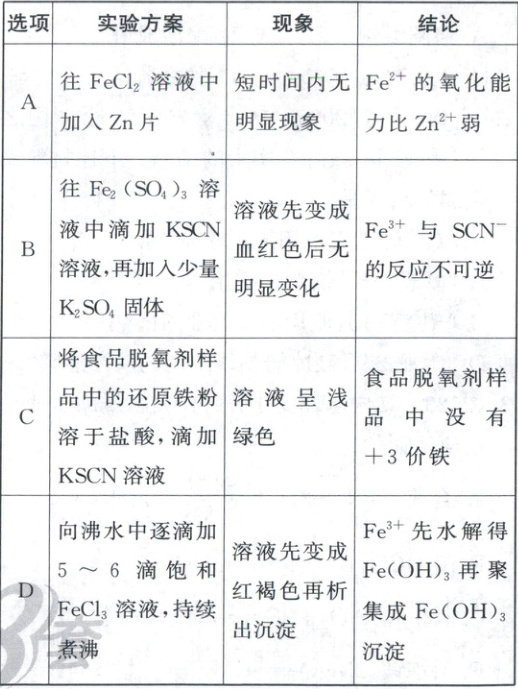
D
)
答案:
4.D 探究铁及其化合物的性质、实验方案设计 锌的还原能力强于铁,往FeCl₂溶液中加入Zn片,Zn和FeCl₂反应后溶液由浅绿色变为无色,Fe²⁺的氧化能力比Zn²⁺强,A错误;往Fe₂(SO₄)₃溶液中滴加KSCN溶液,存在如下平衡,Fe³⁺ + 3SCN⁻⇌Fe(SCN)₃,加入少量的硫酸钾固体,不影响平衡移动,不能说明反应不可逆,B错误;脱氧剂中可能含有+3价铁元素,溶于盐酸时被铁粉还原,故不能说明食品脱氧剂样品中没有+3价铁,C错误;加热能够促进Fe³⁺水解生成Fe(OH)₃胶体,溶液颜色加深,然后持续煮沸时聚沉生成沉淀,D正确。
5. (2022·山东卷,节选·6分)实验室利用${FeCl_{2}· 4H_{2}O}$和亚硫酰氯(${SOCl_{2}}$)制备无水${FeCl_{2}}$的装置如图所示(加热及夹持装置略)。已知${SOCl_{2}}$沸点为$76\ ^{\circ}C$,遇水极易反应生成两种酸性气体。
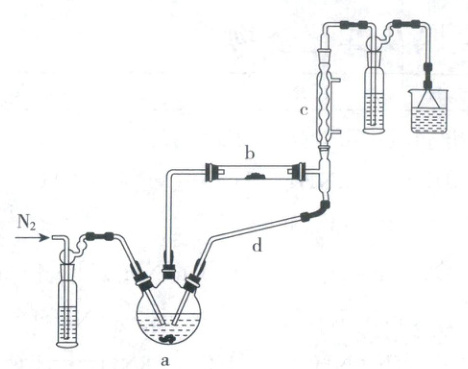
回答下列问题:
(1) 实验开始先通${N_{2}}$。一段时间后,先加热装置
(2) 现有含少量杂质的${FeCl_{2}· nH_{2}O}$,为测定$n$值进行如下实验:
实验Ⅰ:称取$m_{1}\ g$样品,用足量稀硫酸溶解后,用$c\ mol/L\ {K_{2}Cr_{2}O_{7}}$标准溶液滴定${Fe^{2+}}$达终点时消耗$V\ mL$(滴定过程中${Cr_{2}O^{2-}_{7}}$转化为${Cr^{3+}}$,${Cl^{-}}$不反应)。
实验Ⅱ:另取$m_{1}\ g$样品,利用上述装置与足量${SOCl_{2}}$反应后,固体质量为$m_{2}\ g$。则$n=$
A. 样品中含少量${FeO}$杂质
B. 样品与${SOCl_{2}}$反应时失水不充分
C. 实验Ⅰ中,称重后样品发生了潮解
D. 滴定达终点时发现滴定管尖嘴内有气泡生成

回答下列问题:
(1) 实验开始先通${N_{2}}$。一段时间后,先加热装置
a
(填“a”或“b”)。装置b内发生反应的化学方程式为FeCl₂·4H₂O + 4SOCl₂\stackrel{△}{=}FeCl₂ + 4SO₂ + 8HCl
。装置c、d共同起到的作用是冷凝回流
。(2) 现有含少量杂质的${FeCl_{2}· nH_{2}O}$,为测定$n$值进行如下实验:
实验Ⅰ:称取$m_{1}\ g$样品,用足量稀硫酸溶解后,用$c\ mol/L\ {K_{2}Cr_{2}O_{7}}$标准溶液滴定${Fe^{2+}}$达终点时消耗$V\ mL$(滴定过程中${Cr_{2}O^{2-}_{7}}$转化为${Cr^{3+}}$,${Cl^{-}}$不反应)。
实验Ⅱ:另取$m_{1}\ g$样品,利用上述装置与足量${SOCl_{2}}$反应后,固体质量为$m_{2}\ g$。则$n=$
\frac{250(m₁ - m₂)}{27cV}
;下列情况会导致$n$测量值偏小的是AB
(填标号)。A. 样品中含少量${FeO}$杂质
B. 样品与${SOCl_{2}}$反应时失水不充分
C. 实验Ⅰ中,称重后样品发生了潮解
D. 滴定达终点时发现滴定管尖嘴内有气泡生成
答案:
5.(6分)
$(1)a FeCl₂·4H₂O + 4SOCl₂\stackrel{△}{=}FeCl₂ + 4SO₂ + 8HCl $冷凝回流
$(2)\frac{250(m₁ - m₂)}{27cV} AB$
【解析】无水FeCl₂的制备
(1)实验开始先通氮气可排除装置中的空气,一段时间后应先加热装置a,提供SOCl₂蒸气进入装置b,然后加热装置b,二者反应得到无水氯化亚铁,若先加热装置b,FeCl₂·4H₂O受热可能发生水解。装置b中SOCl₂水解消耗FeCl₂·4H₂O中的水从而生成无水FeCl₂,反应的化学方程式为$FeCl₂·4H₂O + 4SOCl₂\stackrel{△}{=}FeCl₂ + 4SO₂ + 8HCl。$装置c、d共同起到冷凝回流的作用,以提高其利用率。
(2)实验Ⅰ,根据得失电子守恒可知:6FeCl₂~K₂Cr₂O₇,m₁g样品中含FeCl₂的物质的量为6cV×10⁻³mol。据实验Ⅱ可知,m₁g样品中含H₂O的质量为(m₁ - m₂)g。则$n = \frac{n(H₂O)}{n(FeCl₂)} = \frac{(m₁ - m₂)g}{18g/mol×6cV×10^{-3}mol} = \frac{250(m₁ - m₂)}{27cV}。$若样品中含少量FeO杂质,则FeO也会与K₂Cr₂O₇反应,使V偏大,n偏小,A正确;样品与SOCl₂反应时失水不充分,会使m₂偏大,导致n偏小,B正确;实验Ⅰ中,称重后,样品发生了潮解,对实验结果无影响,C错误;滴定达终点发现滴定管尖嘴内有气泡生成,则K₂Cr₂O₇体积读数偏小,即V偏小,n偏大,D错误。
$(1)a FeCl₂·4H₂O + 4SOCl₂\stackrel{△}{=}FeCl₂ + 4SO₂ + 8HCl $冷凝回流
$(2)\frac{250(m₁ - m₂)}{27cV} AB$
【解析】无水FeCl₂的制备
(1)实验开始先通氮气可排除装置中的空气,一段时间后应先加热装置a,提供SOCl₂蒸气进入装置b,然后加热装置b,二者反应得到无水氯化亚铁,若先加热装置b,FeCl₂·4H₂O受热可能发生水解。装置b中SOCl₂水解消耗FeCl₂·4H₂O中的水从而生成无水FeCl₂,反应的化学方程式为$FeCl₂·4H₂O + 4SOCl₂\stackrel{△}{=}FeCl₂ + 4SO₂ + 8HCl。$装置c、d共同起到冷凝回流的作用,以提高其利用率。
(2)实验Ⅰ,根据得失电子守恒可知:6FeCl₂~K₂Cr₂O₇,m₁g样品中含FeCl₂的物质的量为6cV×10⁻³mol。据实验Ⅱ可知,m₁g样品中含H₂O的质量为(m₁ - m₂)g。则$n = \frac{n(H₂O)}{n(FeCl₂)} = \frac{(m₁ - m₂)g}{18g/mol×6cV×10^{-3}mol} = \frac{250(m₁ - m₂)}{27cV}。$若样品中含少量FeO杂质,则FeO也会与K₂Cr₂O₇反应,使V偏大,n偏小,A正确;样品与SOCl₂反应时失水不充分,会使m₂偏大,导致n偏小,B正确;实验Ⅰ中,称重后,样品发生了潮解,对实验结果无影响,C错误;滴定达终点发现滴定管尖嘴内有气泡生成,则K₂Cr₂O₇体积读数偏小,即V偏小,n偏大,D错误。
查看更多完整答案,请扫码查看


