2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第62页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
9.(2024·山东卷,4分,不定项)以不同材料修饰的${Pt}$为电极,一定浓度的${NaBr}$溶液为电解液,采用电解和催化相结合的循环方式,可实现高效制${H_{2}}$和${O_{2}}$,装置如图所示。
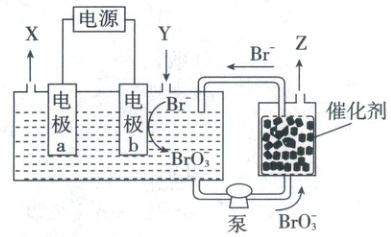
下列说法错误的是 (
A.电极${a}$连接电源负极
B.加入${Y}$的目的是补充${NaBr}$
C.电解总反应式为${Br^{-} + 3H_{2}O\xlongequal{电解}BrO^{-}_{3} + 3H_{2}↑}$
D.催化阶段反应产物物质的量之比$n({Z}):$$n({Br^{-}})=3:2$

下列说法错误的是 (
B
)A.电极${a}$连接电源负极
B.加入${Y}$的目的是补充${NaBr}$
C.电解总反应式为${Br^{-} + 3H_{2}O\xlongequal{电解}BrO^{-}_{3} + 3H_{2}↑}$
D.催化阶段反应产物物质的量之比$n({Z}):$$n({Br^{-}})=3:2$
答案:
9.B 电化学
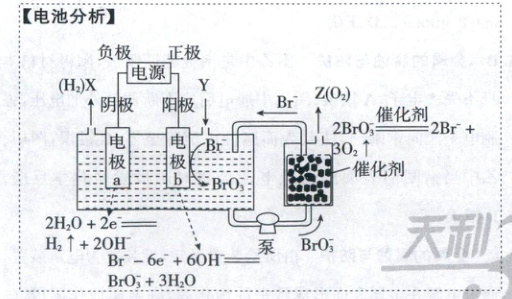
电极a为阴极,连接电源负极,A项正确;根据电极反应式,每转移$6\ mol$电子,阴极消耗$6\ mol\ H_2O$,而阳极生成$3\ mol\ H_2O$,所以加入Y的目的为补充$H_2O$,B项错误;结合阴阳两极电极反应式可得电解总反应式为$Br^-+3H_2O\stackrel{电解}{=\!=\!=}BrO_3^-+3H_2\uparrow$,C项正确;根据催化反应方程式可得$n(O_2):n(Br^-)=3:2$,D项正确。
9.B 电化学

电极a为阴极,连接电源负极,A项正确;根据电极反应式,每转移$6\ mol$电子,阴极消耗$6\ mol\ H_2O$,而阳极生成$3\ mol\ H_2O$,所以加入Y的目的为补充$H_2O$,B项错误;结合阴阳两极电极反应式可得电解总反应式为$Br^-+3H_2O\stackrel{电解}{=\!=\!=}BrO_3^-+3H_2\uparrow$,C项正确;根据催化反应方程式可得$n(O_2):n(Br^-)=3:2$,D项正确。
10.(2024·湖北卷,3分)我国科学家设计了一种双位点${PbCu}$电催化剂,用${H_{2}C_{2}O_{4}}$和${NH_{2}OH}$电化学催化合成甘氨酸,原理如图,双极膜中${H_{2}O}$解离的${H^{+}}$和${OH^{-}}$在电场作用下向两极迁移。已知在${KOH}$溶液中,甲醛转化为${HOCH_{2}O^{-}}$,存在平衡${HOCH_{2}O^{-} + OH^{-}⇌[OCH_{2}O]^{2-} + H_{2}O}$。${Cu}$电极上发生的电子转移反应为${[OCH_{2}O]^{2-} - e^{-}\xlongequal{}HCOO^{-} + H·}$。下列说法错误的是 (
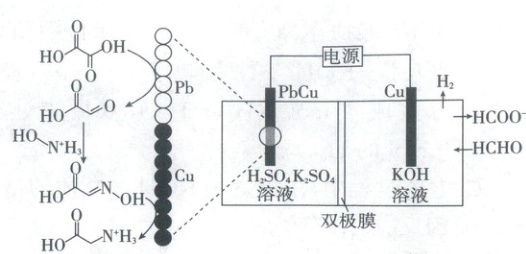
A.电解一段时间后阳极区$c({OH^{-}})$减小
B.理论上生成$1\ {mol}$${H_{3}N^{+}CH_{2}COOH}$双极膜中有$4\ {mol}$${H_{2}O}$解离
C.阳极总反应式为${2HCHO + 4OH^{-} - 2e^{-}\xlongequal{}}$${2HCOO^{-} + H_{2}↑ + 2H_{2}O}$
D.阴极区存在反应${H_{2}C_{2}O_{4} + 2H^{+} + 2e^{-}\xlongequal{}OHCCOOH + H_{2}O}$
B
)
A.电解一段时间后阳极区$c({OH^{-}})$减小
B.理论上生成$1\ {mol}$${H_{3}N^{+}CH_{2}COOH}$双极膜中有$4\ {mol}$${H_{2}O}$解离
C.阳极总反应式为${2HCHO + 4OH^{-} - 2e^{-}\xlongequal{}}$${2HCOO^{-} + H_{2}↑ + 2H_{2}O}$
D.阴极区存在反应${H_{2}C_{2}O_{4} + 2H^{+} + 2e^{-}\xlongequal{}OHCCOOH + H_{2}O}$
答案:
10.B 电化学原理
【电池分析】根据题目信息可知,阳极电极反应式:$[OCHO_2]^{2-}-e^-\xlongequal{}HCOO^-+H^+$,$H^+$转化为$H_2$,其总反应式为$2HCHO-2e^-+4OH^-\xlongequal{}2HCOO^-+2H_2O+H_2\uparrow$,因此$Cu$电极为阳极,$PbCu$电极为阴极,阴极电极反应式:$7H^++NH_2OH+H_2C_2O_4+6e^-\xlongequal{}H_3N^+CH_2COOH+3H_2O$。
阳极失去$2\ mol$电子,消耗$4\ mol\ OH^-$,双极膜会迁移$2\ mol\ OH^-$,因此阳极$c(OH^-)$减小,A正确;根据阴极反应式可知生成$1\ mol\ H_3N^+CH_2COOH$时转移$6\ mol$电子,则双极膜分解$6\ mol$水,B错误;根据【电池分析】可知,阳极总反应式为$2HCHO-2e^-+4OH^-\xlongequal{}2HCOO^-+2H_2O+H_2\uparrow$,C正确;从图中可知,$Pb$电极上$H_2C_2O_4$转化为乙醛酸,存在$H_2C_2O_4+2e^-+2H^+\xlongequal{}OHC-COOH+H_2O$,D正确。
【电池分析】根据题目信息可知,阳极电极反应式:$[OCHO_2]^{2-}-e^-\xlongequal{}HCOO^-+H^+$,$H^+$转化为$H_2$,其总反应式为$2HCHO-2e^-+4OH^-\xlongequal{}2HCOO^-+2H_2O+H_2\uparrow$,因此$Cu$电极为阳极,$PbCu$电极为阴极,阴极电极反应式:$7H^++NH_2OH+H_2C_2O_4+6e^-\xlongequal{}H_3N^+CH_2COOH+3H_2O$。
阳极失去$2\ mol$电子,消耗$4\ mol\ OH^-$,双极膜会迁移$2\ mol\ OH^-$,因此阳极$c(OH^-)$减小,A正确;根据阴极反应式可知生成$1\ mol\ H_3N^+CH_2COOH$时转移$6\ mol$电子,则双极膜分解$6\ mol$水,B错误;根据【电池分析】可知,阳极总反应式为$2HCHO-2e^-+4OH^-\xlongequal{}2HCOO^-+2H_2O+H_2\uparrow$,C正确;从图中可知,$Pb$电极上$H_2C_2O_4$转化为乙醛酸,存在$H_2C_2O_4+2e^-+2H^+\xlongequal{}OHC-COOH+H_2O$,D正确。
11.(2023·广东卷,4分)利用活性石墨电极电解饱和食盐水,进行如图所示实验。闭合${K_{1}}$,一段时间后, (
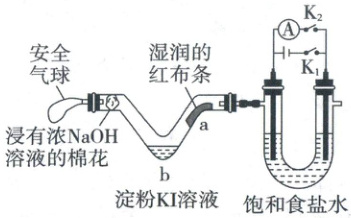
A.${U}$形管两侧均有气泡冒出,分别是${Cl_{2}}$和${O_{2}}$
B.${a}$处布条褪色,说明${Cl_{2}}$具有漂白性
C.${b}$处出现蓝色,说明还原性:${Cl^{-}>I^{-}}$
D.断开${K_{1}}$,立刻闭合${K_{2}}$,电流表发生偏转
D
)
A.${U}$形管两侧均有气泡冒出,分别是${Cl_{2}}$和${O_{2}}$
B.${a}$处布条褪色,说明${Cl_{2}}$具有漂白性
C.${b}$处出现蓝色,说明还原性:${Cl^{-}>I^{-}}$
D.断开${K_{1}}$,立刻闭合${K_{2}}$,电流表发生偏转
答案:
11.D 电解池原理 电解饱和食盐水总反应为$2NaCl+2H_2O\stackrel{电解}{=\!=\!=}2NaOH+Cl_2\uparrow+H_2\uparrow$,阳极得到$Cl_2$,阴极得到$H_2$,A错误;$Cl_2$无漂白性,湿润的红布条褪色是因为$Cl_2$与水反应生成$HClO$具有漂白性,B错误;b处出现蓝色,说明发生反应$Cl_2+2I^-\xlongequal{}I_2+2Cl^-$,说明还原性:$I^->Cl^-$,C错误;断开$K_1$,立刻闭合$K_2$,阳极产生$Cl_2$能与$NaOH$溶液发生氧化还原反应形成原电池,电流表发生偏转,D正确。
12.(2023·广东卷,4分)用一种具有“卯榫”结构的双极膜组装电解池(如图),可实现大电流催化电解${KNO_{3}}$溶液制氨。工作时,${H_{2}O}$在双极膜界面处被催化解离成${H^{+}}$和${OH^{-}}$,有利于电解反应顺利进行。下列说法不正确的是(
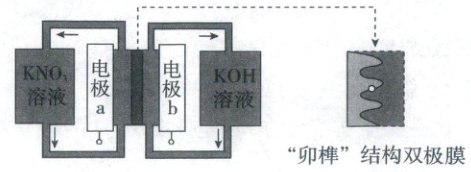
A.电解总反应:${KNO_{3} + 3H_{2}O\xlongequal{}NH_{3}· H_{2}O + 2O_{2}↑ + KOH}$
B.每生成$1\ {mol}$${NH_{3}· H_{2}O}$,双极膜处有$9\ {mol}$的${H_{2}O}$解离
C.电解过程中,阳极室中${KOH}$的物质的量不因反应而改变
D.相比于平面结构双极膜,“卯榫”结构可提高氨生成速率
B
)
A.电解总反应:${KNO_{3} + 3H_{2}O\xlongequal{}NH_{3}· H_{2}O + 2O_{2}↑ + KOH}$
B.每生成$1\ {mol}$${NH_{3}· H_{2}O}$,双极膜处有$9\ {mol}$的${H_{2}O}$解离
C.电解过程中,阳极室中${KOH}$的物质的量不因反应而改变
D.相比于平面结构双极膜,“卯榫”结构可提高氨生成速率
答案:
12.B 电解池原理
【电池分析】由电解池工作示意图可知,$NO_3^-$在电极a表面得到电子转化为氨气,则电极a为阴极,双极膜处水解离产生的$H^+$定向移动至阴极,阴极反应式为$NO_3^-+8e^-+7H_2O\xlongequal{}NH_3·H_2O+9OH^-$;电极b为阳极,电极反应式为$4OH^--4e^-\xlongequal{}O_2\uparrow+2H_2O$。$H_2O$在双极膜界面处解离得到的$H^+$和$OH^-$分别定向移动至阴极区和阳极区。
由阴极和阳极的电极反应式可知,电解总反应为$KNO_3+3H_2O\xlongequal{}NH_3·H_2O+2O_2\uparrow+KOH$,A正确;由阴极反应式可知,每生成$1\ mol\ NH_3·H_2O$,转移$8\ mol\ e^-$,双极膜处应有$8\ mol$的$H_2O$解离,B错误;电解过程中,阳极室消耗的$OH^-$总量与双极膜处迁移至阳极室的$OH^-$总量相等,阳极室中$KOH$的物质的量不发生改变,C正确;相比于平面结构双极膜,“卯榫”结构双极膜的表面积更大,水的解离速率更快,可提高氨生成速率,D正确。
【电池分析】由电解池工作示意图可知,$NO_3^-$在电极a表面得到电子转化为氨气,则电极a为阴极,双极膜处水解离产生的$H^+$定向移动至阴极,阴极反应式为$NO_3^-+8e^-+7H_2O\xlongequal{}NH_3·H_2O+9OH^-$;电极b为阳极,电极反应式为$4OH^--4e^-\xlongequal{}O_2\uparrow+2H_2O$。$H_2O$在双极膜界面处解离得到的$H^+$和$OH^-$分别定向移动至阴极区和阳极区。
由阴极和阳极的电极反应式可知,电解总反应为$KNO_3+3H_2O\xlongequal{}NH_3·H_2O+2O_2\uparrow+KOH$,A正确;由阴极反应式可知,每生成$1\ mol\ NH_3·H_2O$,转移$8\ mol\ e^-$,双极膜处应有$8\ mol$的$H_2O$解离,B错误;电解过程中,阳极室消耗的$OH^-$总量与双极膜处迁移至阳极室的$OH^-$总量相等,阳极室中$KOH$的物质的量不发生改变,C正确;相比于平面结构双极膜,“卯榫”结构双极膜的表面积更大,水的解离速率更快,可提高氨生成速率,D正确。
查看更多完整答案,请扫码查看


