2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第102页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
3.【模块融合】(2024·江苏卷,15分)回收磁性合金钕铁硼(${Nd_{2}Fe_{14}B}$)可制备半导体材料铁酸铋和光学材料氧化钕。
(1)钕铁硼在空气中焙烧转化为${Nd_{2}O_{3}}$、${Fe_{2}O_{3}}$等(忽略硼的化合物),用$0.4\ mol/L$盐酸酸浸后过滤得到${NdCl_{3}}$溶液和含铁滤渣。${Nd}$、${Fe}$浸出率($\dfrac{浸出液中某元素的物质的量}{某元素的总物质的量}× 100\%$)随浸取时间变化如图甲所示。
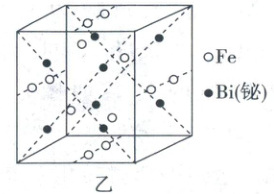
①含铁滤渣的主要成分为
②浸出初期${Fe}$浸出率先上升后下降的原因是
(2)含铁滤渣用硫酸溶解,经萃取、反萃取提纯后,用于制备铁酸铋。
①用含有机胺(${R_{3}N}$)的有机溶剂作为萃取剂提纯一定浓度的${Fe_{2}(SO_{4})_{3}}$溶液,原理为:
${(R_{3}NH)_{2}SO_{4} + Fe^{3+} + SO^{2-}_{4} + H_{2}O\underset{\lower{7mu}{反萃取}}{\overset{萃取}{⇌}}H^{+} + (R_{3}NH)_{2}Fe(OH)(SO_{4})_{2}}$(有机层)
已知:${(R_{3}NH)_{2}SO_{4} + H^{+} + HSO^{-}_{4}⇌ 2(R_{3}NH· HSO_{4})}$
其他条件不变,水层初始${pH}$在$0.2\sim 0.8$范围内,随水层${pH}$增大,有机层中${Fe}$元素含量迅速增多的原因是
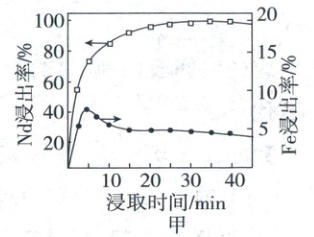
②反萃取后,${Fe_{2}(SO_{4})_{3}}$经转化可得到铁酸铋。铁酸铋晶胞如图乙所示(图中有$4$个${Fe}$原子位于晶胞体对角线上,${O}$原子未画出),其中原子数目比$N({Fe}):N({Bi}) =$
(3)净化后的${NdCl_{3}}$溶液通过沉钕、焙烧得到${Nd_{2}O_{3}}$。
①向${NdCl_{3}}$溶液中加入${(NH_{4})_{2}CO_{3}}$溶液,${Nd^{3+}}$可转化为${Nd(OH)CO_{3}}$沉淀。该反应的离子方程式为
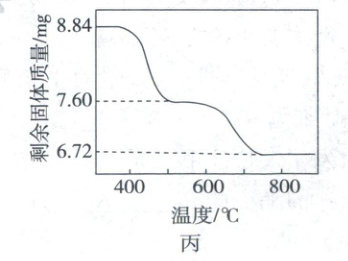
②将$8.84\ mg\ {Nd(OH)CO_{3}}$(摩尔质量为$221\ g/mol$)在氮气氛围中焙烧,剩余固体质量随温度变化曲线如图丙所示。$550\sim 600\ ^{\circ}C$时,所得固体产物可表示为${Nd_{a}O_{b}(CO_{3})_{c}}$,通过以上实验数据确定该产物中$n({Nd^{3+}}):n({CO^{2-}_{3}})$的比值:
(1)钕铁硼在空气中焙烧转化为${Nd_{2}O_{3}}$、${Fe_{2}O_{3}}$等(忽略硼的化合物),用$0.4\ mol/L$盐酸酸浸后过滤得到${NdCl_{3}}$溶液和含铁滤渣。${Nd}$、${Fe}$浸出率($\dfrac{浸出液中某元素的物质的量}{某元素的总物质的量}× 100\%$)随浸取时间变化如图甲所示。

①含铁滤渣的主要成分为
$Fe_{2}O_{3}$
(填化学式)。②浸出初期${Fe}$浸出率先上升后下降的原因是
$Fe_{2}O_{3}$溶于盐酸,$c(H^{+})$减小,$Fe^{3+}$水解进入滤渣
。(2)含铁滤渣用硫酸溶解,经萃取、反萃取提纯后,用于制备铁酸铋。
①用含有机胺(${R_{3}N}$)的有机溶剂作为萃取剂提纯一定浓度的${Fe_{2}(SO_{4})_{3}}$溶液,原理为:
${(R_{3}NH)_{2}SO_{4} + Fe^{3+} + SO^{2-}_{4} + H_{2}O\underset{\lower{7mu}{反萃取}}{\overset{萃取}{⇌}}H^{+} + (R_{3}NH)_{2}Fe(OH)(SO_{4})_{2}}$(有机层)
已知:${(R_{3}NH)_{2}SO_{4} + H^{+} + HSO^{-}_{4}⇌ 2(R_{3}NH· HSO_{4})}$
其他条件不变,水层初始${pH}$在$0.2\sim 0.8$范围内,随水层${pH}$增大,有机层中${Fe}$元素含量迅速增多的原因是
$c(OH^{-})$增大,$SO^{2-}_{4}$量增多,$(R_{3}NH)_{2}SO_{4}$量增多,萃取正向进行程度增加
。②反萃取后,${Fe_{2}(SO_{4})_{3}}$经转化可得到铁酸铋。铁酸铋晶胞如图乙所示(图中有$4$个${Fe}$原子位于晶胞体对角线上,${O}$原子未画出),其中原子数目比$N({Fe}):N({Bi}) =$
8:4或2:1
。
(3)净化后的${NdCl_{3}}$溶液通过沉钕、焙烧得到${Nd_{2}O_{3}}$。
①向${NdCl_{3}}$溶液中加入${(NH_{4})_{2}CO_{3}}$溶液,${Nd^{3+}}$可转化为${Nd(OH)CO_{3}}$沉淀。该反应的离子方程式为
$Nd^{3+}+2CO^{2-}_{3}+H_{2}O=Nd(OH)CO_{3}\downarrow+HCO^{-}_{3}$
。②将$8.84\ mg\ {Nd(OH)CO_{3}}$(摩尔质量为$221\ g/mol$)在氮气氛围中焙烧,剩余固体质量随温度变化曲线如图丙所示。$550\sim 600\ ^{\circ}C$时,所得固体产物可表示为${Nd_{a}O_{b}(CO_{3})_{c}}$,通过以上实验数据确定该产物中$n({Nd^{3+}}):n({CO^{2-}_{3}})$的比值:
焙烧过程中Nd元素物质的量守恒
$n(Nd^{3+})=n[Nd(OH)CO_{3}]=\frac{8.84mg}{221g/mol}=0.04mmol$
焙烧在氮气氛围中进行,最终产物为$Nd_{2}O_{3}$,所以第二阶段的失重为$CO_{2}$。根据C原子守恒,$Nd_{a}O_{b}(CO_{3})_{c}$中的$n(CO^{2-}_{3})$与分解产生的$n(CO_{2})$相等。
$m(CO_{2})=\Delta m_{2}=7.60mg - 6.72mg=0.88mg$
$550\sim600^{\circ}C$时固体产物$Nd_{a}O_{b}(CO_{3})_{c}$中$n(CO^{2-}_{3})=\frac{0.88mg}{44g/mol}=0.02mmol$
$n(Nd^{3+}):n(CO^{2-}_{3})=2:1$
(写出计算过程)。$n(Nd^{3+})=n[Nd(OH)CO_{3}]=\frac{8.84mg}{221g/mol}=0.04mmol$
焙烧在氮气氛围中进行,最终产物为$Nd_{2}O_{3}$,所以第二阶段的失重为$CO_{2}$。根据C原子守恒,$Nd_{a}O_{b}(CO_{3})_{c}$中的$n(CO^{2-}_{3})$与分解产生的$n(CO_{2})$相等。
$m(CO_{2})=\Delta m_{2}=7.60mg - 6.72mg=0.88mg$
$550\sim600^{\circ}C$时固体产物$Nd_{a}O_{b}(CO_{3})_{c}$中$n(CO^{2-}_{3})=\frac{0.88mg}{44g/mol}=0.02mmol$
$n(Nd^{3+}):n(CO^{2-}_{3})=2:1$

答案:
3.(15分)
(1)①$Fe_{2}O_{3}$ ②$Fe_{2}O_{3}$溶于盐酸,$c(H^{+})$减小,$Fe^{3+}$水解进入滤渣
(2)①$c(OH^{-})$增大,$SO^{2-}_{4}$量增多,$(R_{3}NH)_{2}SO_{4}$量增多,萃取正向进行程度增加 ②8:4或2:1
(3)①$Nd^{3+}+2CO^{2-}_{3}+H_{2}O=Nd(OH)CO_{3}\downarrow+HCO^{-}_{3}$
②焙烧过程中Nd元素物质的量守恒
$n(Nd^{3+})=n[Nd(OH)CO_{3}]=\frac{8.84mg}{221g/mol}=0.04mmol$
焙烧在氮气氛围中进行,最终产物为$Nd_{2}O_{3}$,所以第二阶段的失重为$CO_{2}$。根据C原子守恒,$Nd_{a}O_{b}(CO_{3})_{c}$中的$n(CO^{2-}_{3})$与分解产生的$n(CO_{2})$相等。
$m(CO_{2})=\Delta m_{2}=7.60mg - 6.72mg=0.88mg$
$550\sim600^{\circ}C$时固体产物$Nd_{a}O_{b}(CO_{3})_{c}$中$n(CO^{2-}_{3})=\frac{0.88mg}{44g/mol}=0.02mmol$
$n(Nd^{3+}):n(CO^{2-}_{3})=2:1$
【解析】水溶液中的离子反应、物质结构与性质、化学计算
(1)①焙烧后“酸浸”的目的是将浸出元素从固态物质转化为可溶性离子,根据图中信息,随着浸取时间延长Nd的浸出率大于95%,而Fe的最高浸出率约8%。说明此过程中$Nd_{2}O_{3}$几乎全部溶于盐酸转化成$Nd^{3+}$,而$Fe_{2}O_{3}$只有很少部分能转化成$Fe^{3+}$,所以含铁滤渣的主要成分应是未浸出的$Fe_{2}O_{3}$。
(2)②结合晶胞图知,8个Fe位于晶胞面上,4个Fe位于晶胞体内,故1个晶胞含有8个Fe;8个Bi位于晶胞面上,故1个晶胞含有4个Bi,则$N(Fe):N(Bi)=8:4=2:1$。
(3)①题给信息中反应物$(NH_{4})_{2}CO_{3}$属于弱碱性强电解质,$CO^{2-}_{3}$发生水解反应$CO^{2-}_{3}+H_{2}O\rightleftharpoons OH^{-}+HCO^{-}_{3}$,$Nd^{3+}$结合$CO^{2-}_{3}$以及水解产生的$OH^{-}$生成$Nd(OH)CO_{3}$,因此反应的离子方程式为$Nd^{3+}+2CO^{2-}_{3}+H_{2}O=Nd(OH)CO_{3}\downarrow+HCO^{-}_{3}$。
(1)①$Fe_{2}O_{3}$ ②$Fe_{2}O_{3}$溶于盐酸,$c(H^{+})$减小,$Fe^{3+}$水解进入滤渣
(2)①$c(OH^{-})$增大,$SO^{2-}_{4}$量增多,$(R_{3}NH)_{2}SO_{4}$量增多,萃取正向进行程度增加 ②8:4或2:1
(3)①$Nd^{3+}+2CO^{2-}_{3}+H_{2}O=Nd(OH)CO_{3}\downarrow+HCO^{-}_{3}$
②焙烧过程中Nd元素物质的量守恒
$n(Nd^{3+})=n[Nd(OH)CO_{3}]=\frac{8.84mg}{221g/mol}=0.04mmol$
焙烧在氮气氛围中进行,最终产物为$Nd_{2}O_{3}$,所以第二阶段的失重为$CO_{2}$。根据C原子守恒,$Nd_{a}O_{b}(CO_{3})_{c}$中的$n(CO^{2-}_{3})$与分解产生的$n(CO_{2})$相等。
$m(CO_{2})=\Delta m_{2}=7.60mg - 6.72mg=0.88mg$
$550\sim600^{\circ}C$时固体产物$Nd_{a}O_{b}(CO_{3})_{c}$中$n(CO^{2-}_{3})=\frac{0.88mg}{44g/mol}=0.02mmol$
$n(Nd^{3+}):n(CO^{2-}_{3})=2:1$
【解析】水溶液中的离子反应、物质结构与性质、化学计算
(1)①焙烧后“酸浸”的目的是将浸出元素从固态物质转化为可溶性离子,根据图中信息,随着浸取时间延长Nd的浸出率大于95%,而Fe的最高浸出率约8%。说明此过程中$Nd_{2}O_{3}$几乎全部溶于盐酸转化成$Nd^{3+}$,而$Fe_{2}O_{3}$只有很少部分能转化成$Fe^{3+}$,所以含铁滤渣的主要成分应是未浸出的$Fe_{2}O_{3}$。
(2)②结合晶胞图知,8个Fe位于晶胞面上,4个Fe位于晶胞体内,故1个晶胞含有8个Fe;8个Bi位于晶胞面上,故1个晶胞含有4个Bi,则$N(Fe):N(Bi)=8:4=2:1$。
(3)①题给信息中反应物$(NH_{4})_{2}CO_{3}$属于弱碱性强电解质,$CO^{2-}_{3}$发生水解反应$CO^{2-}_{3}+H_{2}O\rightleftharpoons OH^{-}+HCO^{-}_{3}$,$Nd^{3+}$结合$CO^{2-}_{3}$以及水解产生的$OH^{-}$生成$Nd(OH)CO_{3}$,因此反应的离子方程式为$Nd^{3+}+2CO^{2-}_{3}+H_{2}O=Nd(OH)CO_{3}\downarrow+HCO^{-}_{3}$。
查看更多完整答案,请扫码查看


