2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第31页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
2. (2025·安徽卷,14分)侯氏制碱法以${NaCl}$、${CO_{2}}$和${NH_{3}}$为反应物制备纯碱。某实验小组在侯氏制碱法基础上以${NaCl}$和${NH_{4}HCO_{3}}$为反应物,在实验室制备纯碱,步骤如下:
①配制饱和食盐水;
②在水浴加热下,将一定量研细的${NH_{4}HCO_{3}}$加入饱和食盐水中,搅拌,使${NH_{4}HCO_{3}}$溶解,静置,析出${NaHCO_{3}}$晶体;
③将${NaHCO_{3}}$晶体减压过滤、煅烧,得到${Na_{2}CO_{3}}$固体。
回答下列问题:
(1)步骤①中配制饱和食盐水,下列仪器中需要使用的有_______(填名称)。
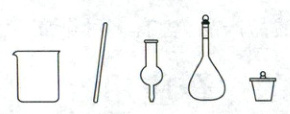
(2)步骤②中${NH_{4}HCO_{3}}$需研细后加入,目的是_______。
(3)在实验室使用${NH_{4}HCO_{3}}$代替${CO_{2}}$和${NH_{3}}$制备纯碱,优点是_______。
(4)实验小组使用滴定法测定了产品的成分。滴定过程中溶液的pH随滴加盐酸体积变化的曲线如图所示。
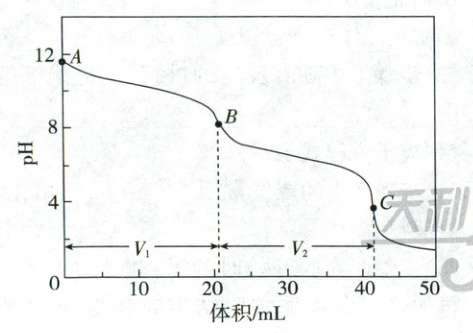
ⅰ.到达第一个滴定终点B时消耗盐酸$V_{1}\ mL$,到达第二个滴定终点C时又消耗盐酸$V_{2}\ mL$。$V_{1}=V_{2}$,所得产品的成分为_______(填标号)。
a.${Na_{2}CO_{3}}$
b.${NaHCO_{3}}$
c.${Na_{2}CO_{3}}$和${NaHCO_{3}}$
d.${Na_{2}CO_{3}}$和${NaOH}$
ⅱ.到达第一个滴定终点前,某同学滴定速度过快,摇动锥形瓶不均匀,致使滴入盐酸局部过浓。该同学所记录的$V_{1}'$_______(填“>”“<”或“=”)$V_{1}$。
(5)已知常温下${Na_{2}CO_{3}}$和${NaHCO_{3}}$的溶解度分别为30.7 g和10.3 g。向饱和${Na_{2}CO_{3}}$溶液中持续通入${CO_{2}}$气体会产生${NaHCO_{3}}$晶体。实验小组进行相应探究:

ⅰ.实验a无明显现象的原因是_______。
ⅱ.析出的白色晶体可能同时含有${NaHCO_{3}}$和${Na_{2}CO_{3}· 10H_{2}O}$。称取0.42 g晾干后的白色晶体,加热至恒重,将产生的气体依次通过足量的无水${CaCl_{2}}$和${NaOH}$溶液,${NaOH}$溶液增重0.088 g,则白色晶体中${NaHCO_{3}}$的质量分数为_______。
①配制饱和食盐水;
②在水浴加热下,将一定量研细的${NH_{4}HCO_{3}}$加入饱和食盐水中,搅拌,使${NH_{4}HCO_{3}}$溶解,静置,析出${NaHCO_{3}}$晶体;
③将${NaHCO_{3}}$晶体减压过滤、煅烧,得到${Na_{2}CO_{3}}$固体。
回答下列问题:
(1)步骤①中配制饱和食盐水,下列仪器中需要使用的有_______(填名称)。

(2)步骤②中${NH_{4}HCO_{3}}$需研细后加入,目的是_______。
(3)在实验室使用${NH_{4}HCO_{3}}$代替${CO_{2}}$和${NH_{3}}$制备纯碱,优点是_______。
(4)实验小组使用滴定法测定了产品的成分。滴定过程中溶液的pH随滴加盐酸体积变化的曲线如图所示。

ⅰ.到达第一个滴定终点B时消耗盐酸$V_{1}\ mL$,到达第二个滴定终点C时又消耗盐酸$V_{2}\ mL$。$V_{1}=V_{2}$,所得产品的成分为_______(填标号)。
a.${Na_{2}CO_{3}}$
b.${NaHCO_{3}}$
c.${Na_{2}CO_{3}}$和${NaHCO_{3}}$
d.${Na_{2}CO_{3}}$和${NaOH}$
ⅱ.到达第一个滴定终点前,某同学滴定速度过快,摇动锥形瓶不均匀,致使滴入盐酸局部过浓。该同学所记录的$V_{1}'$_______(填“>”“<”或“=”)$V_{1}$。
(5)已知常温下${Na_{2}CO_{3}}$和${NaHCO_{3}}$的溶解度分别为30.7 g和10.3 g。向饱和${Na_{2}CO_{3}}$溶液中持续通入${CO_{2}}$气体会产生${NaHCO_{3}}$晶体。实验小组进行相应探究:

ⅰ.实验a无明显现象的原因是_______。
ⅱ.析出的白色晶体可能同时含有${NaHCO_{3}}$和${Na_{2}CO_{3}· 10H_{2}O}$。称取0.42 g晾干后的白色晶体,加热至恒重,将产生的气体依次通过足量的无水${CaCl_{2}}$和${NaOH}$溶液,${NaOH}$溶液增重0.088 g,则白色晶体中${NaHCO_{3}}$的质量分数为_______。
答案:
2.(14分)
(1)烧杯、玻璃棒
(2)增大$\mathrm{NH_4HCO_3}$与饱和食盐水接触面积,加快溶解和反应速率
(3)操作简单、安全环保
(4)ⅰ.a ⅱ.$>$
(5)ⅰ.$\mathrm{CO_2}$与$\mathrm{Na_2CO_3}$溶液反应速率慢,大量$\mathrm{CO_2}$未参与反应便从溶液中逸出,反应生成的$\mathrm{NaHCO_3}$较少,$\mathrm{NaHCO_3}$溶液未达到饱和,无法结晶析出 ⅱ.80%
[解析]纯碱的制备实验
(1)配制饱和食盐水需向烧杯中加入一定量的蒸馏水,再加入氯化钠固体,并用玻璃棒搅拌至固体不再溶解,然后过滤即可。
(3)在实验室使用$\mathrm{NH_4HCO_3}$代替$\mathrm{CO_2}$和$\mathrm{NH_3}$制备纯碱,可以省略制备$\mathrm{CO_2}$和$\mathrm{NH_3}$的实验过程,且$\mathrm{NH_3}$属于污染性气体,极易溶于水,易产生倒吸现象,使用$\mathrm{NH_4HCO_3}$更加安全环保。
(4)ⅰ.两段滴定消耗的盐酸体积相等,结合滴定终点pH和$\mathrm{Na_2CO_3+HCl=NaHCO_3+NaCl}$、$\mathrm{NaHCO_3+HCl=H_2O+CO_2↑+NaCl}$可知,所得产品的成分为$\mathrm{Na_2CO_3}$。ⅱ.到达第一个滴定终点前,某同学滴定速度过快,摇动锥形瓶不均匀 ,致使滴入盐酸局部过浓,局部$\mathrm{Na_2CO_3}$与HCl反应生成$\mathrm{H_2CO_3}$,则达到第一个滴定终点时消耗的盐酸偏多,即$V_1 > V$。
(5)ⅱ.由$2\mathrm{NaHCO_3}\xlongequal{\triangle}\mathrm{Na_2CO_3+CO_2↑+H_2O↑}$和$\mathrm{Na_2CO_3·10H_2O\xlongequal{\triangle}Na_2CO_3+10H_2O↑}$可知,NaOH溶液的增重全部来自$\mathrm{NaHCO_3}$分解得到的$\mathrm{CO_2}$,结合方程式可知分解生成$0.088$g$\mathrm{CO_2}$需要$0.336$g$\mathrm{NaHCO_3}$,则白色晶体中$\mathrm{NaHCO_3}$的质量分数为$\frac{0.336g}{0.42g}$×100% = 80%。
(1)烧杯、玻璃棒
(2)增大$\mathrm{NH_4HCO_3}$与饱和食盐水接触面积,加快溶解和反应速率
(3)操作简单、安全环保
(4)ⅰ.a ⅱ.$>$
(5)ⅰ.$\mathrm{CO_2}$与$\mathrm{Na_2CO_3}$溶液反应速率慢,大量$\mathrm{CO_2}$未参与反应便从溶液中逸出,反应生成的$\mathrm{NaHCO_3}$较少,$\mathrm{NaHCO_3}$溶液未达到饱和,无法结晶析出 ⅱ.80%
[解析]纯碱的制备实验
(1)配制饱和食盐水需向烧杯中加入一定量的蒸馏水,再加入氯化钠固体,并用玻璃棒搅拌至固体不再溶解,然后过滤即可。
(3)在实验室使用$\mathrm{NH_4HCO_3}$代替$\mathrm{CO_2}$和$\mathrm{NH_3}$制备纯碱,可以省略制备$\mathrm{CO_2}$和$\mathrm{NH_3}$的实验过程,且$\mathrm{NH_3}$属于污染性气体,极易溶于水,易产生倒吸现象,使用$\mathrm{NH_4HCO_3}$更加安全环保。
(4)ⅰ.两段滴定消耗的盐酸体积相等,结合滴定终点pH和$\mathrm{Na_2CO_3+HCl=NaHCO_3+NaCl}$、$\mathrm{NaHCO_3+HCl=H_2O+CO_2↑+NaCl}$可知,所得产品的成分为$\mathrm{Na_2CO_3}$。ⅱ.到达第一个滴定终点前,某同学滴定速度过快,摇动锥形瓶不均匀 ,致使滴入盐酸局部过浓,局部$\mathrm{Na_2CO_3}$与HCl反应生成$\mathrm{H_2CO_3}$,则达到第一个滴定终点时消耗的盐酸偏多,即$V_1 > V$。
(5)ⅱ.由$2\mathrm{NaHCO_3}\xlongequal{\triangle}\mathrm{Na_2CO_3+CO_2↑+H_2O↑}$和$\mathrm{Na_2CO_3·10H_2O\xlongequal{\triangle}Na_2CO_3+10H_2O↑}$可知,NaOH溶液的增重全部来自$\mathrm{NaHCO_3}$分解得到的$\mathrm{CO_2}$,结合方程式可知分解生成$0.088$g$\mathrm{CO_2}$需要$0.336$g$\mathrm{NaHCO_3}$,则白色晶体中$\mathrm{NaHCO_3}$的质量分数为$\frac{0.336g}{0.42g}$×100% = 80%。
3. (2024·河北卷,15分)市售的溴(纯度99%)中含有少量的${Cl_{2}}$和${I_{2}}$,某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。
回答下列问题:
(1)装置如图(夹持装置等略),将市售的溴滴入盛有浓${CaBr_{2}}$溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为
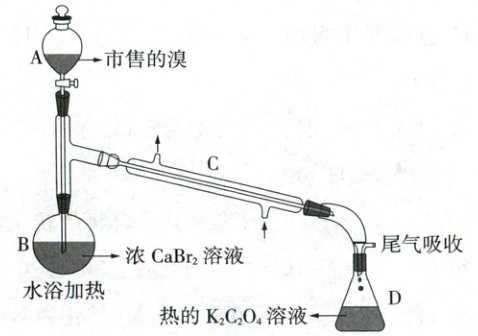
(2)将D中溶液转移至
(3)利用图示相同装置,将R和${K_{2}Cr_{2}O_{7}}$固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓${H_{2}SO_{4}}$,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为
(4)为保证溴的纯度,步骤(3)中${K_{2}Cr_{2}O_{7}}$固体的用量按理论所需量的$\frac{3}{4}$计算,若固体R质量为m克(以${KBr}$计),则需称取
(5)本实验所用钾盐试剂均经重结晶的方法纯化。其中趁热过滤的具体操作为:漏斗下端管口紧靠烧杯内壁,转移溶液时用
回答下列问题:
(1)装置如图(夹持装置等略),将市售的溴滴入盛有浓${CaBr_{2}}$溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为
直形冷凝管
;${CaBr_{2}}$溶液的作用为除去杂质$\mathrm{Cl_2}$
;D中发生的主要反应的化学方程式为$\mathrm{Br_2+K_2C_2O_4=2KBr+2CO_2↑}$
。
(2)将D中溶液转移至
蒸发皿
(填仪器名称)中,边加热边向其中滴加酸化的${KMnO_{4}}$溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成${I_{2}}$的离子方程式为$10\mathrm{I^{-}+2MnO_4^{-}+16H^+=2Mn^{2+}+5I_2+8H_2O}$
。(3)利用图示相同装置,将R和${K_{2}Cr_{2}O_{7}}$固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓${H_{2}SO_{4}}$,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为
液封(或水封)
和除去杂质HBr
。(4)为保证溴的纯度,步骤(3)中${K_{2}Cr_{2}O_{7}}$固体的用量按理论所需量的$\frac{3}{4}$计算,若固体R质量为m克(以${KBr}$计),则需称取
$\frac{m×294×3}{6×119×4}$
g ${K_{2}Cr_{2}O_{7}}(M=294\ g/mol)$(用含m的代数式表示)。(5)本实验所用钾盐试剂均经重结晶的方法纯化。其中趁热过滤的具体操作为:漏斗下端管口紧靠烧杯内壁,转移溶液时用
玻璃棒引流
,滤液沿烧杯壁流下。
答案:
3.(15分)
(1)直形冷凝管 除去杂质$\mathrm{Cl_2}$ $\mathrm{Br_2+K_2C_2O_4=2KBr+2CO_2↑}$
(2)蒸发皿 $10\mathrm{I^{-}+2MnO_4^{-}+16H^+=2Mn^{2+}+5I_2+8H_2O}$
(3)液封(或水封) 除去杂质HBr
(4)$\frac{m×294×3}{6×119×4}$
(5)玻璃棒引流
[解析]溴单质的提纯实验
(1)该套装置为蒸馏装置,C为直形冷凝管;由于市售的溴中含有少量的$\mathrm{Cl_2}$,加入到浓$\mathrm{CaBr_2}$溶液中之后发生反应生成$\mathrm{Br_2}$,除去$\mathrm{Cl_2}$;蒸出的$\mathrm{Br_2}$经冷凝后进入D中,与$\mathrm{K_2C_2O_4}$发生氧化还原反应,$\mathrm{Br_2}$表现氧化性,$\mathrm{K_2C_2O_4}$表现还原性,发生的反应为$\mathrm{Br_2+K_2C_2O_4=2KBr+2CO_2↑}$。
(2)D中溶液含有大量的KBr,还有少量KI,滴加酸性高锰酸钾溶液可以将KI氧化为$\mathrm{I_2}$,当出现红棕色气体时,停止滴加高锰酸钾溶液,直接将溶液蒸干得到固体R,R中含KBr,由于过程中需要加热,且需要将溶液蒸干,因此可以将D中溶液转移至蒸发皿中。
(3)酸性条件下KBr和$\mathrm{K_2Cr_2O_7}$反应生成$\mathrm{Br_2}$,KBr与浓$\mathrm{H_2SO_4}$会生成少量HBr,由于$\mathrm{Br_2}$密度比水大且易挥发,HBr极易溶于水,因此蒸馏水的作用是液封(或水封)和除去HBr杂质。
(4)KBr和$\mathrm{K_2Cr_2O_7}$反应比例为6:1,$m$gKBr的物质的量$n = \frac{m}{119}$mol,则理论上需要$\mathrm{K_2Cr_2O_7}$的量为$\frac{m}{6×119}$mol,需要称取的质量为$\frac{m}{6×119}×\frac{3}{4}×294$g。
(1)直形冷凝管 除去杂质$\mathrm{Cl_2}$ $\mathrm{Br_2+K_2C_2O_4=2KBr+2CO_2↑}$
(2)蒸发皿 $10\mathrm{I^{-}+2MnO_4^{-}+16H^+=2Mn^{2+}+5I_2+8H_2O}$
(3)液封(或水封) 除去杂质HBr
(4)$\frac{m×294×3}{6×119×4}$
(5)玻璃棒引流
[解析]溴单质的提纯实验
(1)该套装置为蒸馏装置,C为直形冷凝管;由于市售的溴中含有少量的$\mathrm{Cl_2}$,加入到浓$\mathrm{CaBr_2}$溶液中之后发生反应生成$\mathrm{Br_2}$,除去$\mathrm{Cl_2}$;蒸出的$\mathrm{Br_2}$经冷凝后进入D中,与$\mathrm{K_2C_2O_4}$发生氧化还原反应,$\mathrm{Br_2}$表现氧化性,$\mathrm{K_2C_2O_4}$表现还原性,发生的反应为$\mathrm{Br_2+K_2C_2O_4=2KBr+2CO_2↑}$。
(2)D中溶液含有大量的KBr,还有少量KI,滴加酸性高锰酸钾溶液可以将KI氧化为$\mathrm{I_2}$,当出现红棕色气体时,停止滴加高锰酸钾溶液,直接将溶液蒸干得到固体R,R中含KBr,由于过程中需要加热,且需要将溶液蒸干,因此可以将D中溶液转移至蒸发皿中。
(3)酸性条件下KBr和$\mathrm{K_2Cr_2O_7}$反应生成$\mathrm{Br_2}$,KBr与浓$\mathrm{H_2SO_4}$会生成少量HBr,由于$\mathrm{Br_2}$密度比水大且易挥发,HBr极易溶于水,因此蒸馏水的作用是液封(或水封)和除去HBr杂质。
(4)KBr和$\mathrm{K_2Cr_2O_7}$反应比例为6:1,$m$gKBr的物质的量$n = \frac{m}{119}$mol,则理论上需要$\mathrm{K_2Cr_2O_7}$的量为$\frac{m}{6×119}$mol,需要称取的质量为$\frac{m}{6×119}×\frac{3}{4}×294$g。
查看更多完整答案,请扫码查看


