2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第71页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
1.$(2025·$甘肃卷,$3$分$)CO_2$加氢转化成甲烷,是综合利用$CO_2$实现“碳中和”和“碳达峰”的重要方式。$525° C$,$101kPa$下,$CO_2(g)+4H_2(g)\rightleftharpoons CH_4(g)+2H_2O(g)\ \ \Delta H=-185kJ/mol$。反应达到平衡时,能使平衡向正反应方向移动的是 (
A.减小体系压强
B.升高温度
C.增大$H_2$浓度
D.恒容下充入惰性气体
C
)A.减小体系压强
B.升高温度
C.增大$H_2$浓度
D.恒容下充入惰性气体
答案:
1.C 化学平衡 该反应为气体分子数减少的反应,减小体系压强,平衡逆向移动,A错误;该反应为放热反应,升高温度,平衡逆向移动,B错误;增大反应物浓度,平衡正向移动,C正确;恒容下充入惰性气体,体系中各组分浓度不改变,平衡不移动,D错误。
2.$(2025·1$月浙江卷,$3$分)下列说法正确的是 (
A.常温常压下$H_2(g)$和$O_2(g)$混合无明显现象,则反应$2H_2(g)+O_2(g)\rightleftharpoons2H_2O(l)$在该条件下不自发
B.$3H_2(g)+N_2(g)\rightleftharpoons2NH_3(g)\ \ \Delta H<0$,升高温度,平衡逆移,则反应的平衡常数减小
C.$CO(g)+H_2O(g)\rightleftharpoons C(s)+H_2O(g)\ \ \Delta H<0$,则正反应的活化能大于逆反应的活化能
D.$Na(s)+\frac{1}{2}Cl_2(g)\rightleftharpoons NaCl(s)\ \ \Delta H<0$,
$Na^+(g)+Cl^-(g)\rightleftharpoons NaCl(s)\ \ \Delta H<0$,则$Na(s)+\frac{1}{2}Cl_2(g)\rightleftharpoons Na^+(g)+Cl^-(g)\ \ \Delta H<0$
B
)A.常温常压下$H_2(g)$和$O_2(g)$混合无明显现象,则反应$2H_2(g)+O_2(g)\rightleftharpoons2H_2O(l)$在该条件下不自发
B.$3H_2(g)+N_2(g)\rightleftharpoons2NH_3(g)\ \ \Delta H<0$,升高温度,平衡逆移,则反应的平衡常数减小
C.$CO(g)+H_2O(g)\rightleftharpoons C(s)+H_2O(g)\ \ \Delta H<0$,则正反应的活化能大于逆反应的活化能
D.$Na(s)+\frac{1}{2}Cl_2(g)\rightleftharpoons NaCl(s)\ \ \Delta H<0$,
$Na^+(g)+Cl^-(g)\rightleftharpoons NaCl(s)\ \ \Delta H<0$,则$Na(s)+\frac{1}{2}Cl_2(g)\rightleftharpoons Na^+(g)+Cl^-(g)\ \ \Delta H<0$
答案:
2.B 反应能量变化与反应的自发性、限度 反应能否自发进行,是热力学问题,但反应实际能否发生,则是动力学问题。H₂(g)与O₂(g)常温下能自发进行反应,但因反应速率极小,故看不到明显现象,A错误;该反应ΔH<0,升高温度,平衡逆向移动,平衡常数减小,B正确;该反应ΔH=Eₐ(正)-Eₐ(逆)<0,所以正反应的活化能小于逆反应的活化能,C错误;根据盖斯定律,前反应-后反应得到目标反应,即ΔH=ΔH前-ΔH后,由于ΔH前、ΔH后的相对大小不确定,所以不能确定目标反应的ΔH是否小于0,D错误。
3.$(2024·$江西卷,$3$分)温度$T$下,向$1L$真空刚性容器中加入$1mol(CH_3)_2CHOH$,反应达到平衡时,$c(Y)=0.4mol/L$。下列说法正确的是
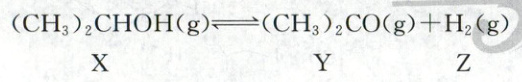
A.再充入$1mol X$和$1mol Y$,此时$v_正<v_逆$
B.再充入$1mol X$,平衡时,$c(Y)=0.8mol/L$
C.再充入$1mol N_2$,平衡向右移动
D.若温度升高,$X$的转化率增加,则上述反应$\Delta H<0$
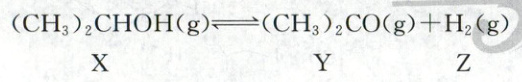
A.再充入$1mol X$和$1mol Y$,此时$v_正<v_逆$
B.再充入$1mol X$,平衡时,$c(Y)=0.8mol/L$
C.再充入$1mol N_2$,平衡向右移动
D.若温度升高,$X$的转化率增加,则上述反应$\Delta H<0$
答案:
3.A 化学平衡 由题中数据可算出该温度下平衡常数K=$\frac{4}{15}$。再充入1molX和1molY后,Q=$\frac{7}{20}$>K,平衡逆向移动,v正<v逆,A正确;该反应正向进行时气体分子数增加且刚性容器容积不变,再充入1molX,X的平衡转化率降低,达新平衡时c(Y)<0.8mol/L,B错误;充入氮气,平衡不移动,C错误;升温,X的转化率增加,说明升温平衡正向移动,正反应吸热,ΔH>0,D错误。
4.$(2024·6$月浙江卷,$3$分)二氧化碳氧化乙烷制备乙烯,主要发生如下两个反应:
Ⅰ.$C_2H_6(g)+CO_2(g)\rightleftharpoons C_2H_4(g)+CO(g)+H_2O(g)\ \ \Delta H_1>0$
Ⅱ.$C_2H_6(g)+2CO_2(g)\rightleftharpoons4CO(g)+3H_2(g)\ \ \Delta H_2>0$
向容积为$10L$的密闭容器中投入$2molC_2H_6$和$3molCO_2$,不同温度下,测得$5min$时(反应均未平衡)的相关数据见表。

注:乙烯选择性$=$$\frac{转化为乙烯的乙烷的物质的量}{转化的乙烷的总物质的量}×100\%$
下列说法不正确的是 (
A.反应活化能:Ⅰ$<$Ⅱ
B.$500° C$时,$0\sim5min$反应Ⅰ的平均速率为:
$v(C_2H_4)=2.88×10^{-3}mol/(L· min)$
C.其他条件不变,平衡后及时移除$H_2O(g)$,可提高乙烯的产率
D.其他条件不变,增大投料比$[\frac{n(C_2H_6)}{n(CO_2)}]$投料,平衡后可提高乙烷转化率
Ⅰ.$C_2H_6(g)+CO_2(g)\rightleftharpoons C_2H_4(g)+CO(g)+H_2O(g)\ \ \Delta H_1>0$
Ⅱ.$C_2H_6(g)+2CO_2(g)\rightleftharpoons4CO(g)+3H_2(g)\ \ \Delta H_2>0$
向容积为$10L$的密闭容器中投入$2molC_2H_6$和$3molCO_2$,不同温度下,测得$5min$时(反应均未平衡)的相关数据见表。

注:乙烯选择性$=$$\frac{转化为乙烯的乙烷的物质的量}{转化的乙烷的总物质的量}×100\%$
下列说法不正确的是 (
D
)A.反应活化能:Ⅰ$<$Ⅱ
B.$500° C$时,$0\sim5min$反应Ⅰ的平均速率为:
$v(C_2H_4)=2.88×10^{-3}mol/(L· min)$
C.其他条件不变,平衡后及时移除$H_2O(g)$,可提高乙烯的产率
D.其他条件不变,增大投料比$[\frac{n(C_2H_6)}{n(CO_2)}]$投料,平衡后可提高乙烷转化率
答案:
4.D 化学反应速率与平衡 乙烯的选择性高于50%,说明反应I的速率大于反应Ⅱ,因此反应活化能:I<Ⅱ,A正确;500℃时,0~5min内生成C₂H₄的物质的量=2×9%×80% = 0.144mol,反应I的平均速率v(C₂H₄)=$\frac{0.144}{10×5}$mol/(L·min)=2.88×10⁻³mol/(L·min),B正确;其他条件不变,平衡后及时移除H₂O(g)可使反应I平衡右移,可提高乙烯的产率,C正确;其他条件不变,增大投料比$\frac{n(C₂H₆)}{n(CO₂)}$投料,平衡后乙烷转化率降低,D错误。
5.$(2024·$重庆卷,$3$分)醋酸甲酯制乙醇的反应为:$CH_3COOCH_3(g)+2H_2(g)\rightleftharpoons\triangle CH_3CH_2OH(g)+CH_3OH(g)$
三个$10L$恒容密闭容器中分别加入$1mol$醋酸甲酯和$9.8mol$氢气,在不同温度下,反应$t$分钟时醋酸甲酯物质的量$n$如图所示。下列说法正确的是 (
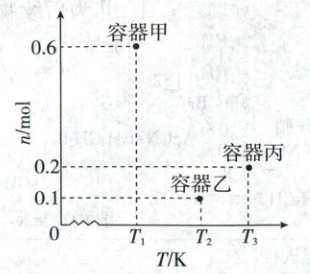
A.该反应的$\Delta H>0$
B.容器甲中平均反应速率$v(H_2)=\frac{4}{5t}mol/(L· min)$
C.容器乙中当前状态下反应速率$v(正)<v(逆)$
D.容器丙中乙醇的体积分数为$8\%$
三个$10L$恒容密闭容器中分别加入$1mol$醋酸甲酯和$9.8mol$氢气,在不同温度下,反应$t$分钟时醋酸甲酯物质的量$n$如图所示。下列说法正确的是 (
D
)
A.该反应的$\Delta H>0$
B.容器甲中平均反应速率$v(H_2)=\frac{4}{5t}mol/(L· min)$
C.容器乙中当前状态下反应速率$v(正)<v(逆)$
D.容器丙中乙醇的体积分数为$8\%$
答案:
5.D 化学平衡图像分析
【图像分析】由图像可知,均反应t分钟,随温度升高,醋酸甲酯的物质的量先减小后增大,说明温度较低时,反应t分钟未达到平衡,随温度升高,反应速率加快,反应t分钟时消耗的醋酸甲酯的物质的量增大,容器中剩余的醋酸甲酯的物质的量减小;温度较高时,反应t分钟时已达到平衡,随温度升高,醋酸甲酯的物质的量增大,说明平衡逆向移动,则该反应为放热反应。
由分析可知,该反应的ΔH<0,A错误;容器甲中平均反应速率v(H₂)=2v(CH₃COOCH₃)=2×$\frac{(1 - 0.6)mol}{10L×t min}$=$\frac{0.08}{t}$mol/(L·min),B错误;由分析可知,容器乙要么未达到平衡,反应正在向正反应方向进行,v(正)>v(逆),要么处于平衡状态,v(正)=v(逆),C错误;结合题意列出三段式:
CH₃COOCH₃(g)+2H₂(g)$\stackrel{\triangle}{\rightleftharpoons}$CH₃CH₂OH(g)+CH₃OH(g)
起始(mol) 1 9.8 0 0
转化(mol) 0.8 1.6 0.8 0.8
平衡(mol) 0.2 8.2 0.8 0.8
则容器丙中气体的总物质的量为(0.2 + 8.2 + 0.8 + 0.8)mol = 10.0mol,则乙醇的体积分数为$\frac{0.8}{10}$×100% = 8%,D正确。
【图像分析】由图像可知,均反应t分钟,随温度升高,醋酸甲酯的物质的量先减小后增大,说明温度较低时,反应t分钟未达到平衡,随温度升高,反应速率加快,反应t分钟时消耗的醋酸甲酯的物质的量增大,容器中剩余的醋酸甲酯的物质的量减小;温度较高时,反应t分钟时已达到平衡,随温度升高,醋酸甲酯的物质的量增大,说明平衡逆向移动,则该反应为放热反应。
由分析可知,该反应的ΔH<0,A错误;容器甲中平均反应速率v(H₂)=2v(CH₃COOCH₃)=2×$\frac{(1 - 0.6)mol}{10L×t min}$=$\frac{0.08}{t}$mol/(L·min),B错误;由分析可知,容器乙要么未达到平衡,反应正在向正反应方向进行,v(正)>v(逆),要么处于平衡状态,v(正)=v(逆),C错误;结合题意列出三段式:
CH₃COOCH₃(g)+2H₂(g)$\stackrel{\triangle}{\rightleftharpoons}$CH₃CH₂OH(g)+CH₃OH(g)
起始(mol) 1 9.8 0 0
转化(mol) 0.8 1.6 0.8 0.8
平衡(mol) 0.2 8.2 0.8 0.8
则容器丙中气体的总物质的量为(0.2 + 8.2 + 0.8 + 0.8)mol = 10.0mol,则乙醇的体积分数为$\frac{0.8}{10}$×100% = 8%,D正确。
查看更多完整答案,请扫码查看


