2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第110页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
3.(2024·湖北卷,13分)铍用于宇航器件的构筑。一种从其铝硅酸盐${[Be_{3}Al_{2}(SiO_{3})_{6}]}$中提取铍的路径为:

已知:${Be^{2+} + 4HA ⇌ BeA_{2}(HA)_{2} + 2H^{+}}$
回答下列问题:
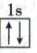
(1)基态${Be^{2+}}$的轨道表示式为
(2)为了从“热熔、冷却”步骤得到玻璃态,冷却过程的特点是
(3)“萃取分液”的目的是分离${Be^{2+}}$和${Al^{3+}}$,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是
(4)写出反萃取生成${Na_{2}[Be(OH)_{4}]}$的化学方程式:
“滤液2”可以进入
(5)电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是
(6)${Be(OH)_{2}}$与醋酸反应得到某含4个${Be}$的配合物,4个${Be}$位于以1个${O}$原子为中心的四面体的4个顶点,且每个${Be}$的配位环境相同,${Be}$与${Be}$间通过${CH_{3}COO^{-}}$相连,其化学式为

已知:${Be^{2+} + 4HA ⇌ BeA_{2}(HA)_{2} + 2H^{+}}$
回答下列问题:
(1)基态${Be^{2+}}$的轨道表示式为
$\uparrow\downarrow$
。(2)为了从“热熔、冷却”步骤得到玻璃态,冷却过程的特点是
迅速降温,快速冷却
。(3)“萃取分液”的目的是分离${Be^{2+}}$和${Al^{3+}}$,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是
先产生白色沉淀,后沉淀溶解
。(4)写出反萃取生成${Na_{2}[Be(OH)_{4}]}$的化学方程式:
BeA₂(HA)₂+6NaOH\xlongequal{}Na₂[Be(OH)₄]+4NaA+2H₂O
。“滤液2”可以进入
反萃取分液
步骤再利用。(5)电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是
增强导电性
。(6)${Be(OH)_{2}}$与醋酸反应得到某含4个${Be}$的配合物,4个${Be}$位于以1个${O}$原子为中心的四面体的4个顶点,且每个${Be}$的配位环境相同,${Be}$与${Be}$间通过${CH_{3}COO^{-}}$相连,其化学式为
Be₄O(CH₃COO)₆
。
答案:
(1)
(2)快速冷却
(3)先出现白色沉淀,后白色沉淀消失
(4)${BeA_{2}(HA) + 6NaOH\xlongequal{}Na_{2}[Be(OH)_{4}] + 4NaA + 2H_{2}O}$
反萃取(分液)
(5)增强导电性
(6)${Be_{4}O(CH_{3}COO)_{6}}$
(1)

(2)快速冷却
(3)先出现白色沉淀,后白色沉淀消失
(4)${BeA_{2}(HA) + 6NaOH\xlongequal{}Na_{2}[Be(OH)_{4}] + 4NaA + 2H_{2}O}$
反萃取(分液)
(5)增强导电性
(6)${Be_{4}O(CH_{3}COO)_{6}}$
4.(2023·北京卷,13分)以银锰精矿(主要含${Ag_{2}S}$、${MnS}$、${FeS_{2}}$)和氧化锰矿(主要含${MnO_{2}}$)为原料联合提取银和锰的一种流程示意图如下。
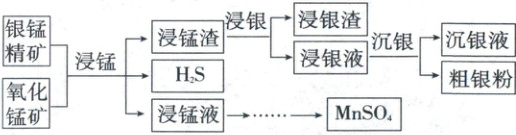
已知:酸性条件下,${MnO_{2}}$的氧化性强于${Fe^{3+}}$。
(1)“浸锰”过程是在${H_{2}SO_{4}}$溶液中使矿石中的锰元素浸出,同时去除${FeS_{2}}$,有利于后续银的浸出:矿石中的银以${Ag_{2}S}$的形式残留于浸锰渣中。
①“浸锰”过程中,发生反应${MnS + 2H^{+}\xlongequal{}Mn^{2+} + H_{2}S\uparrow}$,则可推断:$K_{sp}{(MnS)}$_______(填“>”或“<”)$K_{sp}{(Ag_{2}S)}$。
②在${H_{2}SO_{4}}$溶液中,银锰精矿中的${FeS_{2}}$和氧化锰矿中的${MnO_{2}}$发生反应,则浸锰液中主要的金属阳离子有_______。
(2)“浸银”时,使用过量${FeCl_{3}}$、${HCl}$和${CaCl_{2}}$的混合液作为浸出剂,将${Ag_{2}S}$中的银以${[AgCl_{2}]^{-}}$形式浸出。
①将“浸银”反应的离子方程式补充完整:
$□\ {Fe^{3+}} + {Ag_{2}S} + □$_______$⇌ □$_______$ + 2{[AgCl_{2}]^{-}} + {S}$
②结合平衡移动原理,解释浸出剂中${Cl^{-}}$、${H^{+}}$的作用:_______。
(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有_______。
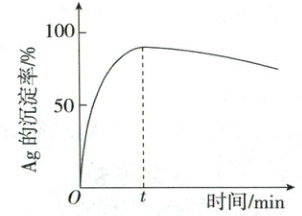
②一定温度下,${Ag}$的沉淀率随反应时间的变化如图所示。解释$t$分钟后${Ag}$的沉淀率逐渐减小的原因:_______。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势:_______。

已知:酸性条件下,${MnO_{2}}$的氧化性强于${Fe^{3+}}$。
(1)“浸锰”过程是在${H_{2}SO_{4}}$溶液中使矿石中的锰元素浸出,同时去除${FeS_{2}}$,有利于后续银的浸出:矿石中的银以${Ag_{2}S}$的形式残留于浸锰渣中。
①“浸锰”过程中,发生反应${MnS + 2H^{+}\xlongequal{}Mn^{2+} + H_{2}S\uparrow}$,则可推断:$K_{sp}{(MnS)}$_______(填“>”或“<”)$K_{sp}{(Ag_{2}S)}$。
②在${H_{2}SO_{4}}$溶液中,银锰精矿中的${FeS_{2}}$和氧化锰矿中的${MnO_{2}}$发生反应,则浸锰液中主要的金属阳离子有_______。
(2)“浸银”时,使用过量${FeCl_{3}}$、${HCl}$和${CaCl_{2}}$的混合液作为浸出剂,将${Ag_{2}S}$中的银以${[AgCl_{2}]^{-}}$形式浸出。
①将“浸银”反应的离子方程式补充完整:
$□\ {Fe^{3+}} + {Ag_{2}S} + □$_______$⇌ □$_______$ + 2{[AgCl_{2}]^{-}} + {S}$
②结合平衡移动原理,解释浸出剂中${Cl^{-}}$、${H^{+}}$的作用:_______。
(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有_______。
②一定温度下,${Ag}$的沉淀率随反应时间的变化如图所示。解释$t$分钟后${Ag}$的沉淀率逐渐减小的原因:_______。

(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势:_______。
答案:
(1)
①>
②${Mn^{2+}}$、${Fe^{3+}}$
(2)
①${2Fe^{3+} + Ag_{2}S + 4Cl^{-}\rightleftharpoons 2Fe^{2+} + 2[AgCl_{2}]^{-} + S}$
②${Ag_{2}S(s)\rightleftharpoons 2Ag^{+}(aq) + S^{2-}(aq)}$,${Cl^{-}}$与${Ag^{+}}$生成${[AgCl_{2}]^{-}}$,${H^{+}}$与${S^{2-}}$生成${H_{2}S}$,可促进${Ag_{2}S}$溶解
(3)
①${2[AgCl_{2}]^{-} + Fe\xlongequal{}2Ag + Fe^{2+} + 4Cl^{-}}$、${2H^{+} + Fe\xlongequal{}}$$Fe^{2+}+H_{2}\uparrow$、$2Fe^{3+}+Fe=3Fe^{2+}$ ②溶解的$O_{2}$(或由$O_{2}$将$Fe^{2+}$氧化成$Fe^{3+}$)可作为氧化剂,使$Ag$转化为$[AgCl_{2}]^{-}$溶解
(4)作氧化剂,作还原剂,两者相互反应;中的锰得到了回收;有利于中银的提取。
(1)
①>
②${Mn^{2+}}$、${Fe^{3+}}$
(2)
①${2Fe^{3+} + Ag_{2}S + 4Cl^{-}\rightleftharpoons 2Fe^{2+} + 2[AgCl_{2}]^{-} + S}$
②${Ag_{2}S(s)\rightleftharpoons 2Ag^{+}(aq) + S^{2-}(aq)}$,${Cl^{-}}$与${Ag^{+}}$生成${[AgCl_{2}]^{-}}$,${H^{+}}$与${S^{2-}}$生成${H_{2}S}$,可促进${Ag_{2}S}$溶解
(3)
①${2[AgCl_{2}]^{-} + Fe\xlongequal{}2Ag + Fe^{2+} + 4Cl^{-}}$、${2H^{+} + Fe\xlongequal{}}$$Fe^{2+}+H_{2}\uparrow$、$2Fe^{3+}+Fe=3Fe^{2+}$ ②溶解的$O_{2}$(或由$O_{2}$将$Fe^{2+}$氧化成$Fe^{3+}$)可作为氧化剂,使$Ag$转化为$[AgCl_{2}]^{-}$溶解
(4)作氧化剂,作还原剂,两者相互反应;中的锰得到了回收;有利于中银的提取。
查看更多完整答案,请扫码查看


