2025年天利38套五年真题高考试题分类化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套五年真题高考试题分类化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第47页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
6. (2022·海南卷,14分)以Cu₂O、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。
回答问题:
(1)基态O原子的电子排布式_______,其中未成对电子有_______个。
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是_______
_______。
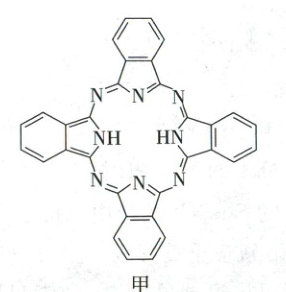
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如图甲,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______杂化。邻苯二甲酸酐 和邻苯二甲酰亚胺
和邻苯二甲酰亚胺 都是合成酞菁的原料,后者熔点高于前者,主要原因是_______。
都是合成酞菁的原料,后者熔点高于前者,主要原因是_______。
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子。Zn与氨水反应的离子方程式为_______。
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能。Zn—N键中离子键成分的百分数小于Zn—O键,原因是_______
_______。
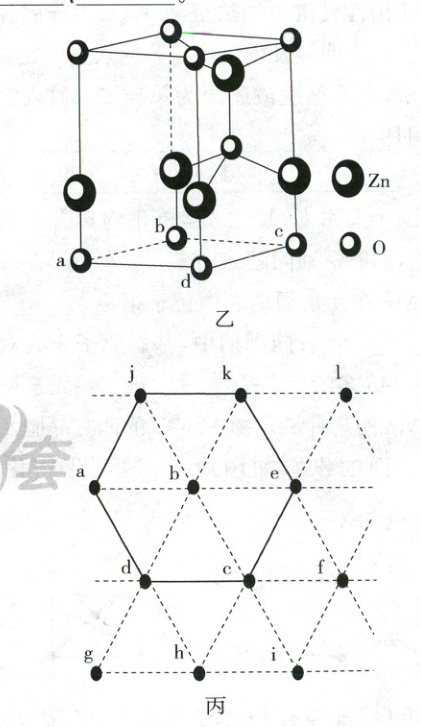
(6)如图乙为某ZnO晶胞示意图,如图丙是若干晶胞无隙并置而成的底面O原子排列局部平面图。$□ abcd$为所取晶胞的下底面,为锐角等于60°的菱形。以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面_______、_______。
回答问题:
(1)基态O原子的电子排布式_______,其中未成对电子有_______个。
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是_______
_______。
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如图甲,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______杂化。邻苯二甲酸酐
 和邻苯二甲酰亚胺
和邻苯二甲酰亚胺 都是合成酞菁的原料,后者熔点高于前者,主要原因是_______。
都是合成酞菁的原料,后者熔点高于前者,主要原因是_______。
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子。Zn与氨水反应的离子方程式为_______。
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能。Zn—N键中离子键成分的百分数小于Zn—O键,原因是_______
_______。
(6)如图乙为某ZnO晶胞示意图,如图丙是若干晶胞无隙并置而成的底面O原子排列局部平面图。$□ abcd$为所取晶胞的下底面,为锐角等于60°的菱形。以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面_______、_______。

答案:
6.(14分)
(1)$1s^{2}2s^{2}2p^{4}$(或[He]2s²2p⁴) 2
(2)自由电子在外加电场中做定向移动
(3)sp² 两者均为分子晶体,后者能形成分子间氢键,使分子间作用力增大,熔点更高
(4)$Zn + 4NH_{3} · H_{2}O = [Zn(NH_{3})_{4}]^{2 + } + 2OH^{-} + H_{2} \uparrow + 2H_{2}O$(或$Zn + 4NH_{3} + 2H_{2}O = [Zn(NH_{3})_{4}]^{2 + } + 2OH^{-} + H_{2} \uparrow$)
(5)电负性O>N,Zn—O键的电负性差大于Zn—N键
(6)bcfe cdhi
[解析]原子结构、化学键及晶体结构
(1)O原子核外共有8个电子,基态O原子的电子排布式为1s²2s²2p⁴或[He]2s²2p⁴,其中2p轨道上有2个未成对电子。
(2)Cu、Zn等金属属于金属晶体,金属晶体是由金属离子和自由电子通过金属键构成,在外加电场的作用下,电子能够定向移动,产生电流。
(3)根据题意可知,分子中所有原子共平面,则N原子为平面形结构,杂化类型为sp²;二者均为分子晶体,且邻苯二甲酰亚胺中N原子上连有H原子,分子之间可以形成氢键,而邻苯二甲酸酐分子间不能形成氢键,故熔点比邻苯二甲酰亚胺低。
(4)Zn与氨水反应生成配位数为4的配位离子,该离子为[Zn(NH₃)₄]²⁺,根据电子守恒可得反应的离子方程式。
(5)O的非金属性比N强,非金属性越强,电负性越大,则Zn—O键的电负性差大于Zn—N键,Zn—O键的离子键成分的百分数大于Zn—N键。
(6)晶胞是平行六面体,晶胞通过平行排列、取向相同的无隙并置形成晶体,根据这一特点,以abcd为参考,与所取晶胞相邻的两个晶胞的底面分别是bcf e和cdhi。
(1)$1s^{2}2s^{2}2p^{4}$(或[He]2s²2p⁴) 2
(2)自由电子在外加电场中做定向移动
(3)sp² 两者均为分子晶体,后者能形成分子间氢键,使分子间作用力增大,熔点更高
(4)$Zn + 4NH_{3} · H_{2}O = [Zn(NH_{3})_{4}]^{2 + } + 2OH^{-} + H_{2} \uparrow + 2H_{2}O$(或$Zn + 4NH_{3} + 2H_{2}O = [Zn(NH_{3})_{4}]^{2 + } + 2OH^{-} + H_{2} \uparrow$)
(5)电负性O>N,Zn—O键的电负性差大于Zn—N键
(6)bcfe cdhi
[解析]原子结构、化学键及晶体结构
(1)O原子核外共有8个电子,基态O原子的电子排布式为1s²2s²2p⁴或[He]2s²2p⁴,其中2p轨道上有2个未成对电子。
(2)Cu、Zn等金属属于金属晶体,金属晶体是由金属离子和自由电子通过金属键构成,在外加电场的作用下,电子能够定向移动,产生电流。
(3)根据题意可知,分子中所有原子共平面,则N原子为平面形结构,杂化类型为sp²;二者均为分子晶体,且邻苯二甲酰亚胺中N原子上连有H原子,分子之间可以形成氢键,而邻苯二甲酸酐分子间不能形成氢键,故熔点比邻苯二甲酰亚胺低。
(4)Zn与氨水反应生成配位数为4的配位离子,该离子为[Zn(NH₃)₄]²⁺,根据电子守恒可得反应的离子方程式。
(5)O的非金属性比N强,非金属性越强,电负性越大,则Zn—O键的电负性差大于Zn—N键,Zn—O键的离子键成分的百分数大于Zn—N键。
(6)晶胞是平行六面体,晶胞通过平行排列、取向相同的无隙并置形成晶体,根据这一特点,以abcd为参考,与所取晶胞相邻的两个晶胞的底面分别是bcf e和cdhi。
查看更多完整答案,请扫码查看


