第8页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
6. 某化学兴趣小组同学为探究硫酸的化学性质,做了如下实验。
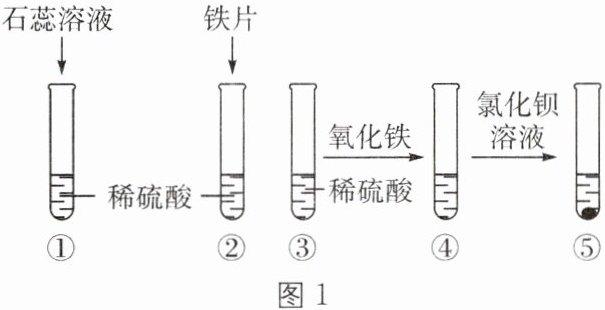
(1)试管①中的现象是
(2)试管③中加入氧化铁反应的化学方程式为
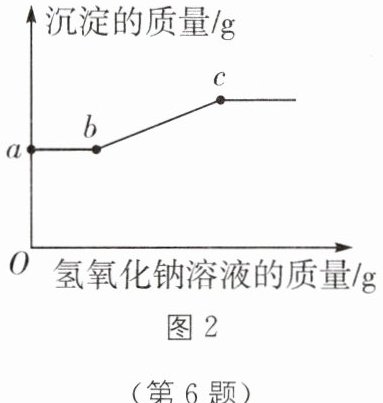
(3)实验中发现试管④中固体全部溶解,试管⑤中产生白色沉淀,接着向试管⑤中滴加氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图 2 所示。则试管④中的溶质有


(1)试管①中的现象是
溶液变为红色
。(2)试管③中加入氧化铁反应的化学方程式为
Fe₂O₃+3H₂SO₄=Fe₂(SO₄)₃+3H₂O
。(3)实验中发现试管④中固体全部溶解,试管⑤中产生白色沉淀,接着向试管⑤中滴加氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图 2 所示。则试管④中的溶质有
H₂SO₄、Fe₂(SO₄)₃
。
答案:
(1)溶液变为红色
(2)Fe₂O₃+3H₂SO₄=Fe₂(SO₄)₃+3H₂O
(3)H₂SO₄、Fe₂(SO₄)₃
(1)溶液变为红色
(2)Fe₂O₃+3H₂SO₄=Fe₂(SO₄)₃+3H₂O
(3)H₂SO₄、Fe₂(SO₄)₃
7. 用玻璃棒蘸硫酸在白纸上写字,如图 1 所示。
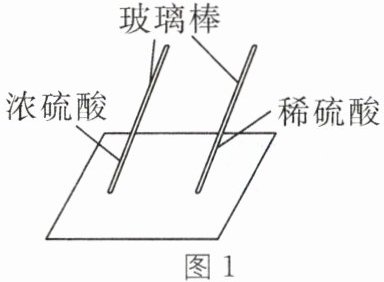
(1)现象:放置一会儿发现用浓硫酸在白纸上写的字变黑,原因是浓硫酸具有
(2)结论:同种酸由于
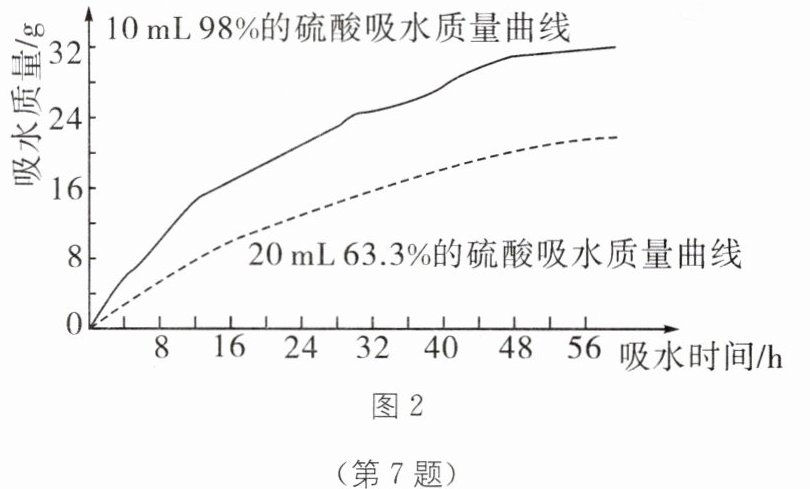
(3)探究浓硫酸的吸水性。兴趣小组把 98%的硫酸 10 mL 和 63.3%的硫酸(用 10 mL 98%的硫酸与 10 mL 水配成)约 20 mL 分别放入两个相同的大表面皿中,称量、观察、记录、分析。根据室温环境下实验的数据绘成的曲线如图 2 所示。由图 2 曲线你能得到什么实验结论?


(1)现象:放置一会儿发现用浓硫酸在白纸上写的字变黑,原因是浓硫酸具有
脱水
性。(2)结论:同种酸由于
浓度
不同,它们的性质不完全相同。(3)探究浓硫酸的吸水性。兴趣小组把 98%的硫酸 10 mL 和 63.3%的硫酸(用 10 mL 98%的硫酸与 10 mL 水配成)约 20 mL 分别放入两个相同的大表面皿中,称量、观察、记录、分析。根据室温环境下实验的数据绘成的曲线如图 2 所示。由图 2 曲线你能得到什么实验结论?
在一定范围内,浓硫酸的浓度越大,吸水性越强
(写一点即可)。
答案:
(1)脱水
(2)浓度
(3)在一定范围内,浓硫酸的浓度越大,吸水性越强
[解析]
(1)浓硫酸能使纸张中的氢、氧元素以水的组成比例脱去,只留下黑色的碳,现象:放置一会儿发现用浓硫酸在白纸上写的字变黑,原因是浓硫酸具有脱水性;
(2)稀硫酸没有脱水性,而浓硫酸具有脱水性,说明同种酸由于浓度(或溶质质量分数)不同,它们的性质不完全相同;
(3)由图2曲线能得到的实验结论:一定范围内,浓硫酸的浓度越大,吸水性越强。
(1)脱水
(2)浓度
(3)在一定范围内,浓硫酸的浓度越大,吸水性越强
[解析]
(1)浓硫酸能使纸张中的氢、氧元素以水的组成比例脱去,只留下黑色的碳,现象:放置一会儿发现用浓硫酸在白纸上写的字变黑,原因是浓硫酸具有脱水性;
(2)稀硫酸没有脱水性,而浓硫酸具有脱水性,说明同种酸由于浓度(或溶质质量分数)不同,它们的性质不完全相同;
(3)由图2曲线能得到的实验结论:一定范围内,浓硫酸的浓度越大,吸水性越强。
8. (2024·温州瑞安期中)金属与酸的反应属于放热反应,现探究酸的质量分数对反应速率的影响,实验室提供如图 1 的器材和颗粒均匀的锌粒、铁片、2%盐酸、4%盐酸、6%盐酸、碎冰、水等试剂。
实验步骤:
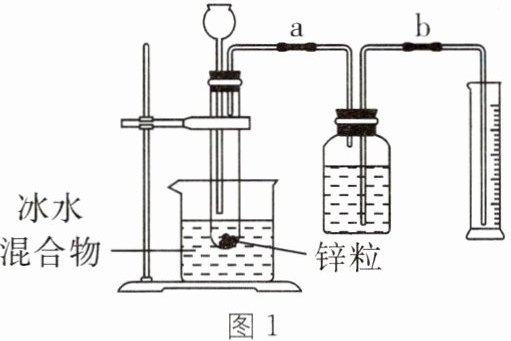
①检查装置气密性,按图 1 连接好实验装置。
②打开止水夹,向长颈漏斗中倒入 $V_{1}\ \text{mL}$ 的溶质质量分数为 2%的盐酸。
③从加入盐酸开始,每隔 30 s,记录量筒中水的体积读数,分别为 $V_{2}\ \text{mL}$、$V_{3}\ \text{mL}$……直至量筒中水的体积不变为止,此时量筒中水的体积读数为 $V_{n}$。
④用等量的 4%和 6%的盐酸替换 2%的盐酸,重复实验步骤②③。
⑤取等量的铁片替换锌粒,重复实验步骤②③。
实验结论:恒温下,盐酸的质量分数越大,金属反应越快。
(1)实验中试管总是固定在冰水混合物中,其目的是______。
(2)步骤③中第一个 30 s 时反应得到的气体体积 $V_{\text{氢气}}$ 为______。
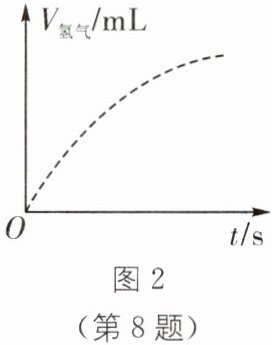
(3)图 2 是某资料中铁与 4%稀硫酸在恒温条件下,生成氢气体积随时间变化的图像。利用上述实验结果,画出铁与 6%稀硫酸在相同温度下,生成氢气体积随时间变化的大致图像。______
实验步骤:


①检查装置气密性,按图 1 连接好实验装置。
②打开止水夹,向长颈漏斗中倒入 $V_{1}\ \text{mL}$ 的溶质质量分数为 2%的盐酸。
③从加入盐酸开始,每隔 30 s,记录量筒中水的体积读数,分别为 $V_{2}\ \text{mL}$、$V_{3}\ \text{mL}$……直至量筒中水的体积不变为止,此时量筒中水的体积读数为 $V_{n}$。
④用等量的 4%和 6%的盐酸替换 2%的盐酸,重复实验步骤②③。
⑤取等量的铁片替换锌粒,重复实验步骤②③。
实验结论:恒温下,盐酸的质量分数越大,金属反应越快。
(1)实验中试管总是固定在冰水混合物中,其目的是______。
(2)步骤③中第一个 30 s 时反应得到的气体体积 $V_{\text{氢气}}$ 为______。
(3)图 2 是某资料中铁与 4%稀硫酸在恒温条件下,生成氢气体积随时间变化的图像。利用上述实验结果,画出铁与 6%稀硫酸在相同温度下,生成氢气体积随时间变化的大致图像。______
答案:
(1)控制化学反应时的温度保持不变
(2)V₂-V₁
(3)
[解析]
(1)实验中试管总是固定在冰水混合物中,控制化学反应时的温度保持不变,防止反应放热引起的温度变化对实验造成的影响。
(2)②打开止水夹,往长颈漏斗中倒入V₁mL的溶质质量分数2%的盐酸,会使V₁mL的水进入量筒中,③从加入盐酸开始,每隔30s,记录量筒中水的体积读数分别为V₂mL、V₃mL……第一个30s时反应得到的气体体积V氢气为V₂-V₁。
(3)硫酸的浓度越高反应的速率越快,且随着反应的进行硫酸的浓度降低,反应速率下降,由于铁的质量相同,所以最终产生氢气的质量相同。
(1)控制化学反应时的温度保持不变
(2)V₂-V₁
(3)

[解析]
(1)实验中试管总是固定在冰水混合物中,控制化学反应时的温度保持不变,防止反应放热引起的温度变化对实验造成的影响。
(2)②打开止水夹,往长颈漏斗中倒入V₁mL的溶质质量分数2%的盐酸,会使V₁mL的水进入量筒中,③从加入盐酸开始,每隔30s,记录量筒中水的体积读数分别为V₂mL、V₃mL……第一个30s时反应得到的气体体积V氢气为V₂-V₁。
(3)硫酸的浓度越高反应的速率越快,且随着反应的进行硫酸的浓度降低,反应速率下降,由于铁的质量相同,所以最终产生氢气的质量相同。
查看更多完整答案,请扫码查看


