第18页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
变式1.3 某些酸和碱溶液反应没有明显现象,某研究性学习小组为证明它们发生了反应进行以下探究,请你参与实验:
方案一:甲同学按下图进行实验。

(1)观察到溶液由红色变为无色,证明两种物质发生反应,反应的化学方程式是
方案二:乙同学取一定量的稀盐酸,向其中逐滴加入氢氧化钠溶液,用传感器测得溶液的pH曲线如图所示。
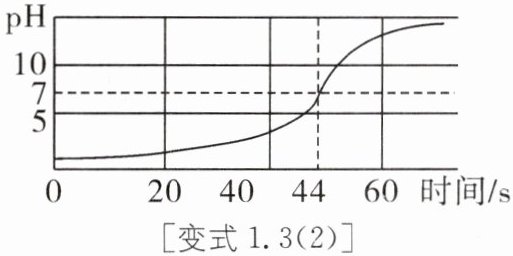
(2)0~40s时,溶液pH变大非常缓慢,其后急剧变大。开始时溶液pH变大非常缓慢的原因可能是
(3)请你根据图像分析稀盐酸和氢氧化钠溶液发生反应的依据是
方案三:丙同学取变色硅胶(吸水后由蓝色变红色)、无水醋酸(一种酸,常温下为无色液体)和氢氧化钠固体进行下图所示的实验。

(4)实验①②的实验目的是
(5)加入试剂后,要迅速塞紧橡胶塞的原因是
(6)能证明酸和碱反应有水生成的现象是
拓展探究:证明稀盐酸和稀氢氧化钠溶液确实能发生反应的方法还有多种,请你和小组同学用其他方案继续进行探究:
(7)若不加酚酞溶液,将稀盐酸与稀氢氧化钠溶液混合后,再
方案一:甲同学按下图进行实验。

(1)观察到溶液由红色变为无色,证明两种物质发生反应,反应的化学方程式是
NaOH+HCl===NaCl+H₂O
。方案二:乙同学取一定量的稀盐酸,向其中逐滴加入氢氧化钠溶液,用传感器测得溶液的pH曲线如图所示。

(2)0~40s时,溶液pH变大非常缓慢,其后急剧变大。开始时溶液pH变大非常缓慢的原因可能是
刚开始时盐酸的浓度大,滴加氢氧化钠溶液,pH变化不明显(刚开始盐酸浓度变化不明显,或氢离子浓度变化不明显)
。60s时溶液中的溶质有NaCl、NaOH
。(3)请你根据图像分析稀盐酸和氢氧化钠溶液发生反应的依据是
溶液的pH逐渐增大,且到44s时,pH=7(或溶液的pH由小于7逐渐变成等于7至大于7或溶液的酸碱性由酸性逐渐变成中性至碱性)
。方案三:丙同学取变色硅胶(吸水后由蓝色变红色)、无水醋酸(一种酸,常温下为无色液体)和氢氧化钠固体进行下图所示的实验。

(4)实验①②的实验目的是
证明了无水醋酸和氢氧化钠不含水,不能使硅胶变色或与③作对照,证明无水醋酸与氢氧化钠反应生成水
。(5)加入试剂后,要迅速塞紧橡胶塞的原因是
防止空气中的水分进入试管干扰实验
。(6)能证明酸和碱反应有水生成的现象是
试管①②中的硅胶不变色,试管③中的硅胶由蓝色变为红色
。拓展探究:证明稀盐酸和稀氢氧化钠溶液确实能发生反应的方法还有多种,请你和小组同学用其他方案继续进行探究:
(7)若不加酚酞溶液,将稀盐酸与稀氢氧化钠溶液混合后,再
向混合后的液体中加入锌粒,无气体产生(合理即可)
,则证明两者确实发生了反应。
答案:
变式1.3
(1)NaOH+HCl===NaCl+H₂O
(2)刚开始时盐酸的浓度大,滴加氢氧化钠溶液,pH变化不明显(刚开始盐酸浓度变化不明显,或氢离子浓度变化不明显) NaCl、NaOH
(3)溶液的pH逐渐增大,且到44s时,pH=7(或溶液的pH由小于7逐渐变成等于7至大于7或溶液的酸碱性由酸性逐渐变成中性至碱性)
(4)证明了无水醋酸和氢氧化钠不含水,不能使硅胶变色或与③作对照,证明无水醋酸与氢氧化钠反应生成水
(5)防止空气中的水分进入试管干扰实验
(6)试管①②中的硅胶不变色,试管③中的硅胶由蓝色变为红色
(7)向混合后的液体中加入锌粒,无气体产生(合理即可)
(1)NaOH+HCl===NaCl+H₂O
(2)刚开始时盐酸的浓度大,滴加氢氧化钠溶液,pH变化不明显(刚开始盐酸浓度变化不明显,或氢离子浓度变化不明显) NaCl、NaOH
(3)溶液的pH逐渐增大,且到44s时,pH=7(或溶液的pH由小于7逐渐变成等于7至大于7或溶液的酸碱性由酸性逐渐变成中性至碱性)
(4)证明了无水醋酸和氢氧化钠不含水,不能使硅胶变色或与③作对照,证明无水醋酸与氢氧化钠反应生成水
(5)防止空气中的水分进入试管干扰实验
(6)试管①②中的硅胶不变色,试管③中的硅胶由蓝色变为红色
(7)向混合后的液体中加入锌粒,无气体产生(合理即可)
查看更多完整答案,请扫码查看


