第37页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
1. (2025·慈溪实验学校期中)膳食均衡是一种健康的生活方式,身体所需的营养物质可以从食物中获取。下列物质富含蛋白质的是(
A.大白菜
B.鸡蛋
C.大米
D.植物油
B
)。A.大白菜
B.鸡蛋
C.大米
D.植物油
答案:
B [解析]大白菜中富含维生素,A 错误;鸡蛋中富含蛋白质,B 正确;大米中富含淀粉,淀粉属于糖类,C 错误;植物油中富含油脂,D 错误。
2. 2024 年世界环境日中国主题是“全面推进美丽中国建设”,下列做法不符合这一主题的是(
A.使用一次性碗筷,树立健康意识
B.积极植树造林,促进达成“碳中和”
C.煤炭脱硫处理,有效减少酸雨的产生
D.使用新型可降解塑料,减少“白色污染”
A
)。A.使用一次性碗筷,树立健康意识
B.积极植树造林,促进达成“碳中和”
C.煤炭脱硫处理,有效减少酸雨的产生
D.使用新型可降解塑料,减少“白色污染”
答案:
2.A
3. 传统文化 慈溪“文化名片” (2025·慈溪实验学校期中)近年来,随着短视频产业的兴起,慈溪的“文化名片”传播到全国各地。
(1)旅游文化:鸣鹤古镇以其独特的山水风光吸引了无数游客。迷人的景色常常让人忘却饥饿,在旅途中人体内首先能利用的供能物质是
(2)历史文化:越窑青瓷,作为唐宋时期青瓷的中心产区,展现了慈溪的深厚历史底蕴。青釉的“翠色”是利用还原剂(CO),在高温下使氧化铁还原变成氧化亚铁而变色。写出其对应的化学方程式:
(1)旅游文化:鸣鹤古镇以其独特的山水风光吸引了无数游客。迷人的景色常常让人忘却饥饿,在旅途中人体内首先能利用的供能物质是
糖类
。(2)历史文化:越窑青瓷,作为唐宋时期青瓷的中心产区,展现了慈溪的深厚历史底蕴。青釉的“翠色”是利用还原剂(CO),在高温下使氧化铁还原变成氧化亚铁而变色。写出其对应的化学方程式:
${CO +Fe_{2}O_{3}\xlongequal{\text{高温}}2FeO +CO_{2}}$
。
答案:
3.
(1)糖类
(2)${CO +Fe_{2}O_{3}\xlongequal{\text{高温}}2FeO +CO_{2}}$
[解析]
(1)糖类是人体内的主要供能物质,脂肪是人体内最主要的备用能源物质。在旅途中人体内首先能利用的供能物质是糖类。
(2)一氧化碳和氧化铁在高温下反应生成氧化亚铁和二氧化碳,反应的化学方程式为${CO +Fe_{2}O_{3}\xlongequal{\text{高温}}2FeO +CO_{2}}$。
(1)糖类
(2)${CO +Fe_{2}O_{3}\xlongequal{\text{高温}}2FeO +CO_{2}}$
[解析]
(1)糖类是人体内的主要供能物质,脂肪是人体内最主要的备用能源物质。在旅途中人体内首先能利用的供能物质是糖类。
(2)一氧化碳和氧化铁在高温下反应生成氧化亚铁和二氧化碳,反应的化学方程式为${CO +Fe_{2}O_{3}\xlongequal{\text{高温}}2FeO +CO_{2}}$。
4. 妈妈为小志的十六岁生日聚会准备了很多物品,其中蕴含着丰富的化学知识,请回答下列问题。
(1)奶油蛋糕的配料表如图,其中富含的营养素是
|原料:大豆油、牛奶、鸡蛋、面粉、发酵粉、蔗糖|
|储存方法:低温冷藏|
|保质期:3 天|
|生产日期:2025 年 4 月 16 日|

(2)生日礼物:一套涤纶材料的运动服。涤纶属于
a. 金属材料
b. 无机非金属材料
c. 有机合成材料
d. 复合材料
(3)聚会上一些物品包装塑料袋上有如图的标志,这类标志表示该塑料弃物应该放入
]

(1)奶油蛋糕的配料表如图,其中富含的营养素是
油脂、蛋白质
(任写两种)。|原料:大豆油、牛奶、鸡蛋、面粉、发酵粉、蔗糖|
|储存方法:低温冷藏|
|保质期:3 天|
|生产日期:2025 年 4 月 16 日|

(2)生日礼物:一套涤纶材料的运动服。涤纶属于
c
(填字母)。a. 金属材料
b. 无机非金属材料
c. 有机合成材料
d. 复合材料
(3)聚会上一些物品包装塑料袋上有如图的标志,这类标志表示该塑料弃物应该放入
可回收
(填“可回收”或“不可回收”)垃圾箱内。已知:“PVC”为聚氯乙烯代号,“PE”为聚乙烯代号,其中制成薄膜可用于包装食品的是PE
(填“PVC”或“PE)。]

答案:
4.
(1)油脂、蛋白质(合理即可)
(2)c
(3)可回收 PE
[解析]
(1)由奶油蛋糕的配料表可知,其中富含的营养素包括油脂、蛋白质、糖类等。
(2)合成纤维“涤纶”是人工合成的有机高分子化合物,属于有机合成材料,故选 c。
(3)由包装塑料袋上的标志可知,该塑料弃物应该放入可回收垃圾箱;“PE”为聚乙烯代号,无毒,制成薄膜可用于包装食品。
(1)油脂、蛋白质(合理即可)
(2)c
(3)可回收 PE
[解析]
(1)由奶油蛋糕的配料表可知,其中富含的营养素包括油脂、蛋白质、糖类等。
(2)合成纤维“涤纶”是人工合成的有机高分子化合物,属于有机合成材料,故选 c。
(3)由包装塑料袋上的标志可知,该塑料弃物应该放入可回收垃圾箱;“PE”为聚乙烯代号,无毒,制成薄膜可用于包装食品。
5. (2025·温州苍南县期中)目前,免拆型手术缝合线广泛应用于手术中,它是用新型生物降解材料——聚乳酸$[(C_{3}H_{4}O_{2})_{n}]$制作而成。聚乳酸可以通过以下路径制取:

(1)从物质分类角度看,葡萄糖属于
(2)中间产物乳酸$(C_{3}H_{6}O_{3})$所含碳元素和氧元素的质量比为
(3)如果二氧化碳中的碳元素全部进入聚乳酸,则生产 3.6 kg 聚乳酸,消耗二氧化碳的质量为

(1)从物质分类角度看,葡萄糖属于
有机物
(填“有机物”或“无机物”)。(2)中间产物乳酸$(C_{3}H_{6}O_{3})$所含碳元素和氧元素的质量比为
3:4
。(3)如果二氧化碳中的碳元素全部进入聚乳酸,则生产 3.6 kg 聚乳酸,消耗二氧化碳的质量为
6.6
kg。
答案:
5.
(1)有机物
(2)$3:4$
(3)6.6
[解析]
(1)葡萄糖是含碳元素的化合物,属于有机物。
(2)乳酸(${C_{3}H_{6}O_{3}}$)中碳元素和氧元素的质量比为$(12× 3):(16× 3)=3:4$。
(3)如果二氧化碳中的碳元素全部进入聚乳酸,则生产 3.6 kg 聚乳酸,消耗二氧化碳的质量为$3.6\ \text{kg}× \frac{12× 3n}{(12× 3+1× 4+16× 2)× n}× 100\%÷ (\frac{12}{44}× 100\%)=6.6\ \text{kg}$。
(1)有机物
(2)$3:4$
(3)6.6
[解析]
(1)葡萄糖是含碳元素的化合物,属于有机物。
(2)乳酸(${C_{3}H_{6}O_{3}}$)中碳元素和氧元素的质量比为$(12× 3):(16× 3)=3:4$。
(3)如果二氧化碳中的碳元素全部进入聚乳酸,则生产 3.6 kg 聚乳酸,消耗二氧化碳的质量为$3.6\ \text{kg}× \frac{12× 3n}{(12× 3+1× 4+16× 2)× n}× 100\%÷ (\frac{12}{44}× 100\%)=6.6\ \text{kg}$。
6. 中考新考法 实验原理拓展 因发现青蒿素而获诺贝尔奖的科学家屠呦呦还发现了双氢青蒿素。查阅资料可知,双氢青蒿素由碳、氢、氧三种元素组成。为测定双氢青蒿素中碳、氢、氧三种元素的质量比,兴趣小组进行了以下探究。
【设计实验】兴趣小组设计并进行了如图 1 所示的实验(装置气密性良好)。
将 7.1 g 双氢青蒿素放在装置 C 的玻璃管中,燃烧至无固体灰分残留。
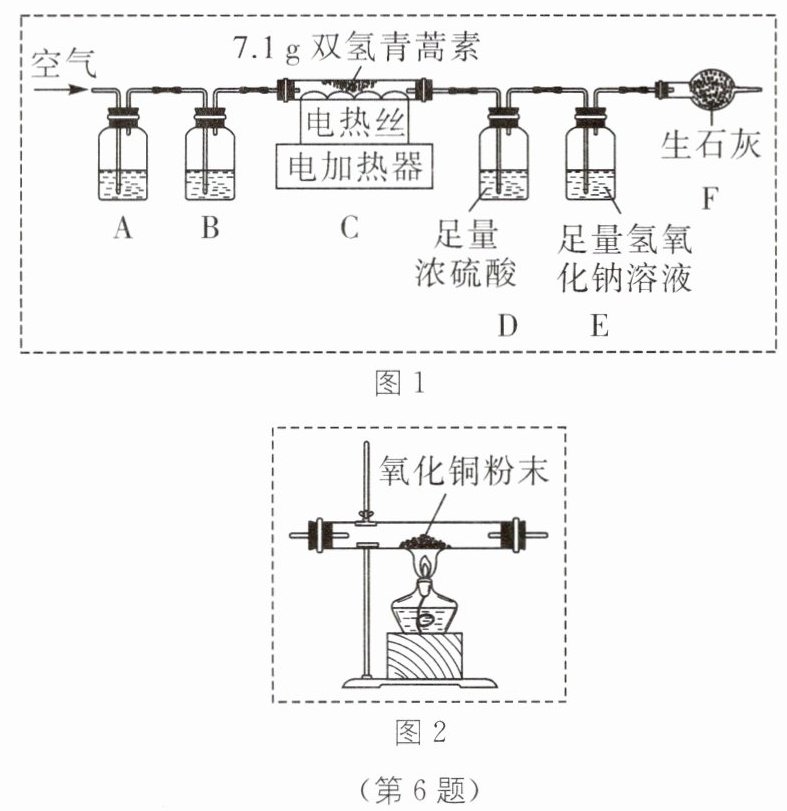
(1)装置 A、B 中盛放的试剂分别是
①足量 NaOH 溶液、足量浓硫酸
②足量浓硫酸、足量 NaOH 溶液
(2)装置 F 可吸收从装置 E 的气流中带出来的少量水蒸气,生石灰与水蒸气发生反应的化学方程式是
【记录数据】加热前,先通入空气一段时间,再称量装置 D 的质量、装置 E 和 F 的总质量(反应前的质量)。双氢青蒿素完全反应后,停止加热,继续通入空气一段时间,再次称量装置 D 的质量、装置 E 和 F 的总质量(反应后的质量)。实验数据如下表所示。
|装置|反应前的质量/g|反应后的质量/g|
|D|87.8|93.2|
|E 和 F|189.7|206.2|

【实验结论】
(3)根据表中数据分析,双氢青蒿素中碳、氢两种元素的质量比是
【拓展分析】
(4)双氢青蒿素分子中碳、氢、氧三种原子的个数比是
【实验反思】
(5)实验过程中加热前要先通入空气一段时间,该操作作用是
(6)有同学建议,为使实验结果更准确,需要在装置 C 和 D 之间增加图所示的装置,其目的是
【设计实验】兴趣小组设计并进行了如图 1 所示的实验(装置气密性良好)。
将 7.1 g 双氢青蒿素放在装置 C 的玻璃管中,燃烧至无固体灰分残留。

(1)装置 A、B 中盛放的试剂分别是
①
(填序号)。①足量 NaOH 溶液、足量浓硫酸
②足量浓硫酸、足量 NaOH 溶液
(2)装置 F 可吸收从装置 E 的气流中带出来的少量水蒸气,生石灰与水蒸气发生反应的化学方程式是
${CaO +H_{2}O\xlongequal{}Ca(OH)_{2}}$
。【记录数据】加热前,先通入空气一段时间,再称量装置 D 的质量、装置 E 和 F 的总质量(反应前的质量)。双氢青蒿素完全反应后,停止加热,继续通入空气一段时间,再次称量装置 D 的质量、装置 E 和 F 的总质量(反应后的质量)。实验数据如下表所示。
|装置|反应前的质量/g|反应后的质量/g|
|D|87.8|93.2|
|E 和 F|189.7|206.2|

【实验结论】
(3)根据表中数据分析,双氢青蒿素中碳、氢两种元素的质量比是
$45:6:20$
。【拓展分析】
(4)双氢青蒿素分子中碳、氢、氧三种原子的个数比是
$15:24:5$
。【实验反思】
(5)实验过程中加热前要先通入空气一段时间,该操作作用是
将装置中的二氧化碳和水蒸气排尽,以免影响实验结果
。(6)有同学建议,为使实验结果更准确,需要在装置 C 和 D 之间增加图所示的装置,其目的是
将双氢青蒿素不完全燃烧产生的一氧化碳全部转化为二氧化碳
。
答案:
6.
(1)①
(2)${CaO +H_{2}O\xlongequal{}Ca(OH)_{2}}$
(3)$45:6:20$
(4)$15:24:5$
(5)将装置中的二氧化碳和水蒸气排尽,以免影响实验结果
(6)将双氢青蒿素不完全燃烧产生的一氧化碳全部转化为二氧化碳
[解析]
(1)空气中含有二氧化碳和水蒸气,会干扰实验结果的测定;氢氧化钠溶液可以吸收二氧化碳、浓硫酸可以吸收水,且气体应该先除杂后干燥,防止气体带出氢氧化钠溶液中的水,故装置 A 盛放的试剂是足量 NaOH 溶液,B 盛放的是足量浓硫酸,故选①。
(2)生石灰与水反应生成氢氧化钙,化学方程式为${CaO +H_{2}O\xlongequal{}Ca(OH)_{2}}$。
(3)装置 D 中浓硫酸吸收生成的水,装置增加质量就是生成水的质量:$93.2\ \text{g}-87.8\ \text{g}=5.4\ \text{g}$;装置 E、F 可以吸收生成的二氧化碳气体及从装置 E 的气流中带出来的少量水蒸气,装置 E 和 F 增加的总质量就是生成二氧化碳的质量:$206.2\ \text{g}-189.7\ \text{g}=16.5\ \text{g}$;反应前后元素种类质量不变,双氢青蒿素中碳、氢质量等于生成二氧化碳、水中碳、氢元素质量,分别为$16.5\ \text{g}× \frac{12}{44}× 100\%=4.5\ \text{g}$、$5.4\ \text{g}× \frac{2}{18}× 100\%=0.6\ \text{g}$,则 7.1 g 双氢青蒿素中氧元素质量为$7.1\ \text{g}-4.5\ \text{g}-0.6\ \text{g}=2\ \text{g}$,双氢青蒿素中碳、氢、氧三种元素的质量比是$45:6:20$。
(5)开始实验前装置中的空气含有二氧化碳和水蒸气,会影响实验结果,实验过程中加热前要先通入空气一段时间,该操作的作用是排除装置中含有的二氧化碳和水蒸气的干扰。
(6)如果双氢青蒿素不充分燃烧生成一氧化碳,不能被装置 E、F 吸收造成实验误差,图2中是一氧化碳和氧化铜在高温下反应生成铜和二氧化碳,一氧化碳能还原氧化铜转化为二氧化碳,使测量结果更准确。
(1)①
(2)${CaO +H_{2}O\xlongequal{}Ca(OH)_{2}}$
(3)$45:6:20$
(4)$15:24:5$
(5)将装置中的二氧化碳和水蒸气排尽,以免影响实验结果
(6)将双氢青蒿素不完全燃烧产生的一氧化碳全部转化为二氧化碳
[解析]
(1)空气中含有二氧化碳和水蒸气,会干扰实验结果的测定;氢氧化钠溶液可以吸收二氧化碳、浓硫酸可以吸收水,且气体应该先除杂后干燥,防止气体带出氢氧化钠溶液中的水,故装置 A 盛放的试剂是足量 NaOH 溶液,B 盛放的是足量浓硫酸,故选①。
(2)生石灰与水反应生成氢氧化钙,化学方程式为${CaO +H_{2}O\xlongequal{}Ca(OH)_{2}}$。
(3)装置 D 中浓硫酸吸收生成的水,装置增加质量就是生成水的质量:$93.2\ \text{g}-87.8\ \text{g}=5.4\ \text{g}$;装置 E、F 可以吸收生成的二氧化碳气体及从装置 E 的气流中带出来的少量水蒸气,装置 E 和 F 增加的总质量就是生成二氧化碳的质量:$206.2\ \text{g}-189.7\ \text{g}=16.5\ \text{g}$;反应前后元素种类质量不变,双氢青蒿素中碳、氢质量等于生成二氧化碳、水中碳、氢元素质量,分别为$16.5\ \text{g}× \frac{12}{44}× 100\%=4.5\ \text{g}$、$5.4\ \text{g}× \frac{2}{18}× 100\%=0.6\ \text{g}$,则 7.1 g 双氢青蒿素中氧元素质量为$7.1\ \text{g}-4.5\ \text{g}-0.6\ \text{g}=2\ \text{g}$,双氢青蒿素中碳、氢、氧三种元素的质量比是$45:6:20$。
(5)开始实验前装置中的空气含有二氧化碳和水蒸气,会影响实验结果,实验过程中加热前要先通入空气一段时间,该操作的作用是排除装置中含有的二氧化碳和水蒸气的干扰。
(6)如果双氢青蒿素不充分燃烧生成一氧化碳,不能被装置 E、F 吸收造成实验误差,图2中是一氧化碳和氧化铜在高温下反应生成铜和二氧化碳,一氧化碳能还原氧化铜转化为二氧化碳,使测量结果更准确。
查看更多完整答案,请扫码查看


