第58页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
2. (多选)(2024·龙东中考)有一包固体样品,可能由氢氧化钠、硫酸钠、硝酸镁、硝酸铜、碳酸钙中的一种或几种物质组成。为确定该样品的成分,某兴趣小组同学取适量样品进行探究:
步骤1:取一定量的固体试剂,加入足量的水充分溶解、过滤、洗涤、干燥,得到1g白色沉淀a和无色滤液b。
步骤2:向白色沉淀a中加入过量的稀盐酸充分反应,沉淀全部溶解,生成0.22g气体。
步骤3:向无色滤液b中加入过量的氢氧化钡溶液,生成白色沉淀c。
步骤4:向白色沉淀c中加入过量的稀盐酸,只有部分沉淀溶解。
根据以上信息判断,下列说法正确的是(
A.白色沉淀a的成分只有碳酸钙
B.无色滤液b中溶质为硫酸钠、硝酸钠、硝酸镁
C.该样品中一定有硝酸镁、氢氧化钠、碳酸钙,一定没有硝酸铜、硝酸钠
D.若步骤3用硝酸钡溶液代替氢氧化钡溶液,不进行步骤4的探究也能得出相同结论
步骤1:取一定量的固体试剂,加入足量的水充分溶解、过滤、洗涤、干燥,得到1g白色沉淀a和无色滤液b。
步骤2:向白色沉淀a中加入过量的稀盐酸充分反应,沉淀全部溶解,生成0.22g气体。
步骤3:向无色滤液b中加入过量的氢氧化钡溶液,生成白色沉淀c。
步骤4:向白色沉淀c中加入过量的稀盐酸,只有部分沉淀溶解。
根据以上信息判断,下列说法正确的是(
BD
)。A.白色沉淀a的成分只有碳酸钙
B.无色滤液b中溶质为硫酸钠、硝酸钠、硝酸镁
C.该样品中一定有硝酸镁、氢氧化钠、碳酸钙,一定没有硝酸铜、硝酸钠
D.若步骤3用硝酸钡溶液代替氢氧化钡溶液,不进行步骤4的探究也能得出相同结论
答案:
BD [解析]取一定量的固体试剂,加入足量的水充分溶解、过滤、洗涤、干燥,得到1g白色沉淀a和无色滤液b,由无色滤液b可知,样品中不含硝酸铜,碳酸钙难溶于水,氢氧化钠和硝酸镁反应会生成氢氧化镁沉淀,则1g白色沉淀中可能只含有碳酸钙,或含有碳酸钙和氢氧化镁;向沉淀a中加入过量的稀盐酸充分反应,沉淀全部溶解,生成0.22g气体,由化学方程式计量数关系可知,100g碳酸钙能生成44g二氧化碳,故0.5g碳酸钙能生成0.22g二氧化碳,则1g白色沉淀含有碳酸钙和氢氧化镁,说明固体样品中一定含有碳酸钙、氢氧化钠和硝酸镁;向无色滤液b中加入过量的氢氧化钡溶液,生成白色沉淀c,氢氧化钡能与硫酸钠反应生成不溶于稀盐酸的硫酸钡沉淀,氢氧化钡与硝酸镁反应生成可溶于稀盐酸的氢氧化镁沉淀,向白色沉淀c中加入过量的稀盐酸,只有部分沉淀溶解,说明白色沉淀c为硫酸钡和氢氧化镁,则无色滤液b中溶质为硝酸镁、硫酸钠及生成的硝酸钠,综上,样品中有氢氧化钠、硫酸钠、硝酸镁、碳酸钙,没有硝酸铜。由分析可知,A、C错误,B正确;若步骤1、2保持不变,用硝酸钡溶液代替步骤3中的氢氧化钡溶液,硝酸盐都是可溶的,且溶液中无碳酸根离子,故有沉淀生成说明一定是钡离子和硫酸根离子生成的硫酸钡沉淀,故有硫酸根离子,即固体样品中一定有硫酸钠,故不需要进行步骤4的探究,也能确定该样品的组成,D正确。
变式2.1 (2024·武汉中考)如图所示物质及变化均是初中化学常见的纯净物及反应。其中甲、乙、丙均是单质且由不同种元素组成,丁是氧化物。“——”表示相连两种物质可以反应,“→”表示一种物质通过一步反应可以转化成另一种物质。
下列说法错误的是(
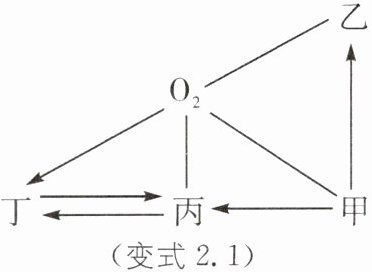
A.甲→乙反应前后一定存在元素化合价的改变
B.甲、丙可以都是金属,且金属活动性:甲>丙
$C.O_2→$丁的反应体现了氧气的氧化性
D.丁→丙的反应一定属于置换反应
下列说法错误的是(
D
)。
A.甲→乙反应前后一定存在元素化合价的改变
B.甲、丙可以都是金属,且金属活动性:甲>丙
$C.O_2→$丁的反应体现了氧气的氧化性
D.丁→丙的反应一定属于置换反应
答案:
D [解析]甲、乙均为单质,单质中元素化合价为0,而化合物中元素的化合价不为0,则甲→乙反应前后一定存在元素化合价的改变,A正确;若甲、丙都是金属,且甲能把丙置换出来,则说明金属活动性顺序:甲>丙,B正确;物质和氧气的反应属于氧化反应,其中体现了氧气的氧化性,C正确;丁为氧化物,丙为单质,若丁为氧化铜.丙为铜.一氧化碳和氧化铜在加热条件下生成铜和二氧化碳.不属于置换反应,D错误。
变式2.2 一包固体粉末可能含有$NaNO_3、$$CaCO_3、$NaOH、$CuCl_2、$NaCl和$Ca(NO_3)_2$中的一种或几种,为确定其组成,某同学设计了如下实验方案,下列判断正确的是(
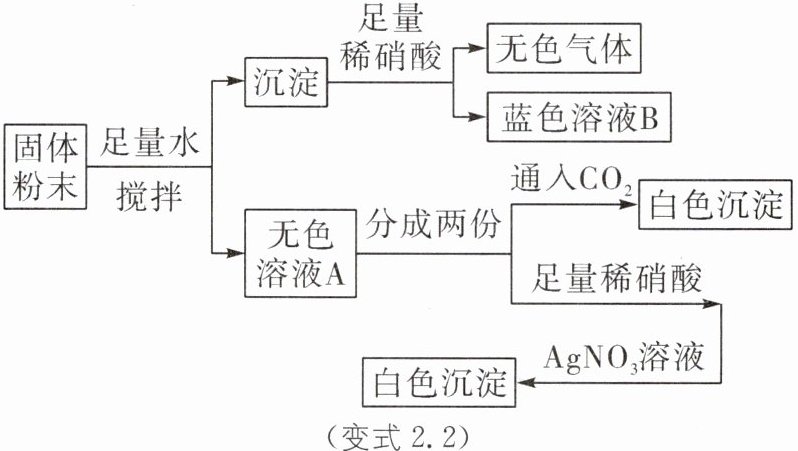
A.蓝色溶液B中金属阳离子只有$Cu^2⁺$
B.原固体粉末一定有NaOH
C.原固体粉末一定有NaCl
D.原固体粉末一定有$CaCO_3、$NaOH、$NaNO_3、$$CuCl_2$和$Ca(NO_3)_2$
B
)。
A.蓝色溶液B中金属阳离子只有$Cu^2⁺$
B.原固体粉末一定有NaOH
C.原固体粉末一定有NaCl
D.原固体粉末一定有$CaCO_3、$NaOH、$NaNO_3、$$CuCl_2$和$Ca(NO_3)_2$
答案:
B [解析]铜离子在溶液中显蓝色,NaOH和CuCl₂会生成氢氧化铜沉淀,而氢氧化铜沉淀与稀硝酸反应生成硝酸铜溶液;CaCO₃和硝酸反应会生成气体,则蓝色溶液B中含有硝酸铜、硝酸钙,原固体粉末一定有CaCO₃₃、NaOH、CuCl₂;无色溶液A通入CO₂后,生成白色沉淀.沉淀应为碳酸钙.原固体粉末中肯定存在Ca(NO₃)₂;无色溶液A加入稀硝酸和硝酸银溶液后,生成白色沉淀,应该为氯化银,其中的氯离子可能来自氯化铜,也可能来自氯化钠,因此是否存在氯化钠无法确定.据此分析判断。蓝色溶液B中金属阳离子应该是铜离子和钙离子,A错误;原固体粉末肯定存在氢氧化钠,B正确;原来固体中是否存在NaCl无法判断,C错误;原固体粉末一定有CaCO₃、NaOH₂CuCl₂和Ca(NO₃)₂,无法判断是否存在NaNO₃,D错误₂₃
变式2.3 有一包白色固体样品,可能由硫酸钠、氯化镁、碳酸钙、氢氧化钠、氯化钡中的一种或几种物质组成,为了探究其组成,学习小组的同学们取适量样品按如图流程进行实验。
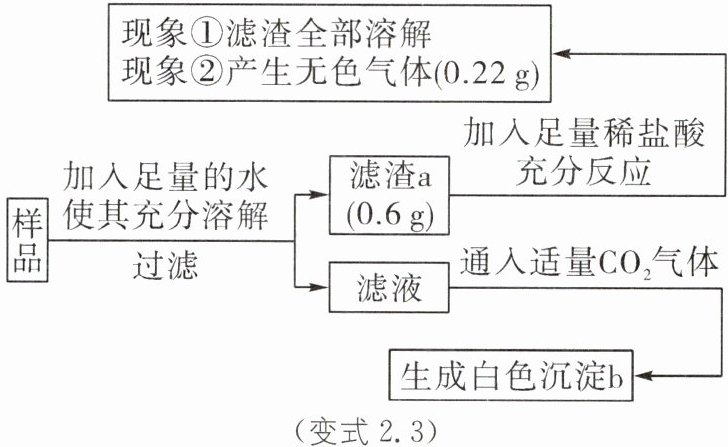
(1)写出现象②的化学方程式:______
(2)原白色固体中一定不存在的物质是______
(3)滤液中一定含有的离子有______

(1)写出现象②的化学方程式:______
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑
。(2)原白色固体中一定不存在的物质是______
硫酸钠(或Na₂SO₄)
。(3)滤液中一定含有的离子有______
Na⁺、Ba²⁺、OH⁻、Cl⁻
(填离子符号)。
答案:
(1)CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑
(2)硫酸钠(或Na₂SO₄) (3)Na⁺、Ba²⁺、OH⁻、Cl⁻
[解析]根据碳酸钙难溶于水,钡离子和硫酸根离子会生成不溶于盐酸的硫酸钡沉淀,氢氧化钠和氯化镁反应会产生氢氧化镁沉淀,碳酸钙和盐酸反应会生成二氧化碳气体,结合化学方程式计算等知识进行分析。根据题意可知,滤渣a加入足量稀盐酸后全部溶解,产生无色气体,则滤渣a一定不含有硫酸钡沉淀,肯定含有碳酸钙沉淀。设产生0.22g的二氧化碳需要碳酸钙的质量为x,
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑
100 44
x 0.22g
100/44=x/0.22g,解得x=0.5g<0.6g,因此滤渣a还有氢氧化镁,则沉淀a是碳酸钙和氢氧化镁,样品中一定有氢氧化钠、氯化镁。
(1)现象②为碳酸钙和稀盐酸反应,生成氯化钙、水和二氧化碳气体,则反应的化学方程式为CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑。
(2)由于滤渣a中没有硫酸钡沉淀,但滤液中有氯化钡存在,故原白色固体中肯定没有硫酸钠。
(3)因滤液中通入二氧化碳气体,能产生沉淀,说明一定有氢氧化钠,原因是二氧化碳与氢氧化钠反应生成碳酸钠和水,碳酸钠再与氯化钡生成碳酸钡,则滤液中一定含有的离子为Na⁺、Ba²⁺、OH⁻、Cl⁻。
(2)硫酸钠(或Na₂SO₄) (3)Na⁺、Ba²⁺、OH⁻、Cl⁻
[解析]根据碳酸钙难溶于水,钡离子和硫酸根离子会生成不溶于盐酸的硫酸钡沉淀,氢氧化钠和氯化镁反应会产生氢氧化镁沉淀,碳酸钙和盐酸反应会生成二氧化碳气体,结合化学方程式计算等知识进行分析。根据题意可知,滤渣a加入足量稀盐酸后全部溶解,产生无色气体,则滤渣a一定不含有硫酸钡沉淀,肯定含有碳酸钙沉淀。设产生0.22g的二氧化碳需要碳酸钙的质量为x,
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑
100 44
x 0.22g
100/44=x/0.22g,解得x=0.5g<0.6g,因此滤渣a还有氢氧化镁,则沉淀a是碳酸钙和氢氧化镁,样品中一定有氢氧化钠、氯化镁。
(1)现象②为碳酸钙和稀盐酸反应,生成氯化钙、水和二氧化碳气体,则反应的化学方程式为CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑。
(2)由于滤渣a中没有硫酸钡沉淀,但滤液中有氯化钡存在,故原白色固体中肯定没有硫酸钠。
(3)因滤液中通入二氧化碳气体,能产生沉淀,说明一定有氢氧化钠,原因是二氧化碳与氢氧化钠反应生成碳酸钠和水,碳酸钠再与氯化钡生成碳酸钡,则滤液中一定含有的离子为Na⁺、Ba²⁺、OH⁻、Cl⁻。
查看更多完整答案,请扫码查看


