第50页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
1.(2024·乐山中考)铁有多种氧化物,为探究其中一种氧化物${Fe_{x}O_{y}}$的组成,某同学将$m\ \text{g}\ {Fe_{x}O_{y}}和10\ \text{g}\ {CO}$置于密闭容器中在高温下发生反应。反应开始至某时刻,测得容器中部分物质的质量变化关系如图所示。下列说法正确的是(

A.a 表示${Fe}$的质量变化
B.$n= 5.6$
C.${Fe_{x}O_{y}}中x:y= 2:3$
D.$m\geqslant11.6$
D
)。
A.a 表示${Fe}$的质量变化
B.$n= 5.6$
C.${Fe_{x}O_{y}}中x:y= 2:3$
D.$m\geqslant11.6$
答案:
D [解析]一氧化碳和铁的氧化物反应生成铁和二氧化碳,随着反应的进行,二氧化碳的质量逐渐增大,一氧化碳的质量逐渐减少,铁的质量逐渐增大,则a表示CO的质量变化,b表示Fe的质量变化,A错误;当生成8.8g二氧化碳时,根据碳元素质量守恒,则参加反应的一氧化碳的质量为$\frac{8.8\,\text{g}× \frac{12}{44}× 100\%}{\frac{12}{28}× 100\%}=5.6\,\text{g}$,则n g=10 g-5.6 g=4.4 g,B错误;当生成8.8g二氧化碳时,生成铁的质量为8.4g,参加反应的一氧化碳的质量为5.6g,根据质量守恒定律,则参加反应的铁的氧化物的质量为8.8g+8.4g-5.6g=11.6g,根据铁元素质量守恒,铁的氧化物中铁元素的质量为8.4g,则氧元素的质量为11.6g-8.4g=3.2g,则${Fe_xO_y}$中$x:y=\frac{8.4\,\text{g}}{56}:\frac{3.2\,\text{g}}{16}=3:4$,C错误;由上述分析可知,参加反应的铁的氧化物的质量为11.6g,则加入的铁的氧化物的质量m g≥11.6g,D正确。
2. 用图1装置还原{Fe_{2}O_{3}}的过程中,常常先生成{Fe_{3}O_{4}},后生成{FeO},最后生成{Fe}。现实验室用{CO}还原$24\ \text{g}\ {Fe_{2}O_{3}},$测得残留固体的质量随温度的变化如图2所示(图中各点对应固体均为纯净物)。下列说法不正确的是(
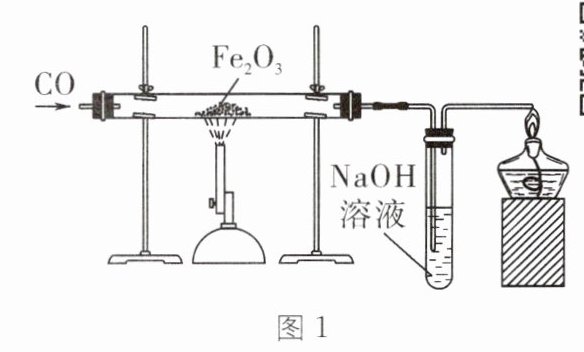
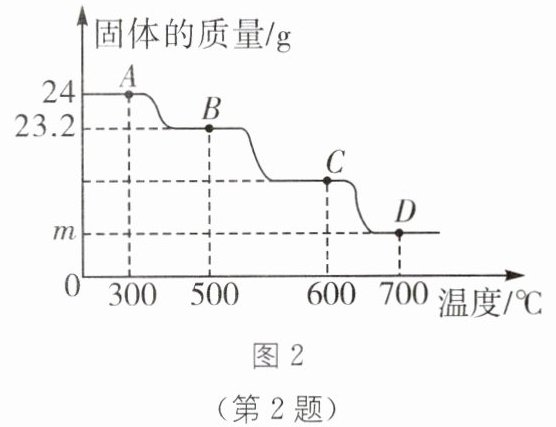
A.实验时应先通入一氧化碳,再加热玻璃管
B.当温度为$300~500\ ^{\circ}\text{C}$时,氢氧化钠溶液共增重$0.8\ \text{g}$
C.$B\rightarrow C发生反应的化学方程式为{Fe_{3}O_{4} + CO\xlongequal{500~600\ ^{\circ}\text{C}}3FeO + CO_{2}}$
D.$m= 16.8$
B
)。

A.实验时应先通入一氧化碳,再加热玻璃管
B.当温度为$300~500\ ^{\circ}\text{C}$时,氢氧化钠溶液共增重$0.8\ \text{g}$
C.$B\rightarrow C发生反应的化学方程式为{Fe_{3}O_{4} + CO\xlongequal{500~600\ ^{\circ}\text{C}}3FeO + CO_{2}}$
D.$m= 16.8$
答案:
B [解析]实验时应先通入一氧化碳,再加热玻璃管,A正确;当温度为300~500℃时,固体质量减少了24g-23.2g=0.8g,减少的质量是固体中氧元素的质量,由于生成的二氧化碳中一半的氧元素来自该反应的金属氧化物,故生成的二氧化碳的质量为$\frac{0.8\,\text{g}}{\frac{16}{44}× 100\%}=2.2\,\text{g}$,氢氧化钠溶液可以吸收二氧化碳,故氢氧化钠溶液增重2.2g,B错误;B→C发生反应的化学方程式为${Fe_3O_4 + CO\xlongequal{500\text{~}600℃}3FeO + CO_2}$,C正确;m点的固体成分为铁,24g${Fe_2O_3}$完全反应生成的铁的质量为$24\,\text{g}× \frac{112}{160}× 100\%=16.8\,\text{g}$,故m=16.8,D正确。
3.(2025·金华义乌期中)人类要在月球上居住,首先离不开淡水和氧气,而月球上的水主要以气态水和固态水的形式存在,也没有可直接呼吸的空气。科学家发现月球的沙土中含有丰富的含氧钛铁矿,成分为${TiO_{2}}$、${Fe_{2}O_{3}}$的混合物,利用${CO}$将这些矿石还原来提炼单质钛和铁,若用氢气还原,可以得到淡水。将这些矿石通电,还可以从中分离出氧气。
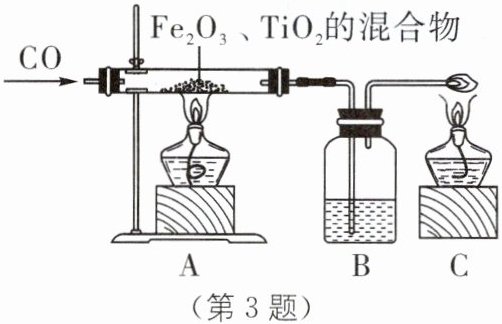
(1)从铁生锈条件来分析,月球上铁制品______
(2)现利用${CO}来还原{TiO_{2}}$、${Fe_{2}O_{3}}$的混合物提炼单质钛和铁,装置如图所示,就实验操作顺序的问题,两位同学出现了分歧。小月认为先通一段时间${CO}$以排空装置内空气,然后再点燃C和A处的酒精灯,小亮认为这样做不好;小亮认为先点燃C和A处的酒精灯,然后再通${CO}$,小月又提出反对。老师认为他们的操作都有一定道理,请你帮助这两位同学解决他们的困难,你的办法是______

(1)从铁生锈条件来分析,月球上铁制品______
不易
(填“易”或“不易”)生锈,原因是______铁生锈需要与氧气和水同时接触,月球上没有太多的液态水和空气,不满足铁生锈的条件
。(2)现利用${CO}来还原{TiO_{2}}$、${Fe_{2}O_{3}}$的混合物提炼单质钛和铁,装置如图所示,就实验操作顺序的问题,两位同学出现了分歧。小月认为先通一段时间${CO}$以排空装置内空气,然后再点燃C和A处的酒精灯,小亮认为这样做不好;小亮认为先点燃C和A处的酒精灯,然后再通${CO}$,小月又提出反对。老师认为他们的操作都有一定道理,请你帮助这两位同学解决他们的困难,你的办法是______
先点燃C处的酒精灯,再通CO排尽装置内空气,最后点燃A处酒精灯
。
答案:
(1)不易 铁生锈需要与氧气和水同时接触,月球上没有太多的液态水和空气,不满足铁生锈的条件
(2)先点燃C处的酒精灯,再通CO排尽装置内空气,最后点燃A处酒精灯
(1)不易 铁生锈需要与氧气和水同时接触,月球上没有太多的液态水和空气,不满足铁生锈的条件
(2)先点燃C处的酒精灯,再通CO排尽装置内空气,最后点燃A处酒精灯
4. 用含有二氧化碳和水蒸气两种杂质的某种还原性气体(氢气和一氧化碳中的一种)测定某种铁的氧化物(${Fe_{x}O_{y}}$)的组成,实验装置如图所示。据图回答下列问题:

(1)实验过程中,丁装置没有明显变化,而戊装置的溶液中出现了白色沉淀,则该还原性气体是______
(2)当丙装置中的${Fe_{x}O_{y}}$全部被还原后,称量剩余固体的质量为$16.8\ \text{g}$,同时测得戊装置的质量增加了$17.6\ \text{g}$。则该铁的氧化物的化学式为______

(1)实验过程中,丁装置没有明显变化,而戊装置的溶液中出现了白色沉淀,则该还原性气体是______
一氧化碳或CO
。(2)当丙装置中的${Fe_{x}O_{y}}$全部被还原后,称量剩余固体的质量为$16.8\ \text{g}$,同时测得戊装置的质量增加了$17.6\ \text{g}$。则该铁的氧化物的化学式为______
${Fe_3O_4}$
。
答案:
(1)一氧化碳或CO
(2)${Fe_3O_4}$ [解析]
(1)丁装置盛放的是无水硫酸铜,无水硫酸铜遇水会变蓝,用于检验是否有水生成,丁装置没有明显变化,说明没有水生成,故该还原性气体不是氢气,戊装置盛放的是澄清石灰水,二氧化碳能使澄清石灰水变浑浊,用于检验是否有二氧化碳生成,戊装置中出现了白色沉淀,说明生成了二氧化碳,故该还原性气体是一氧化碳;
(2)丙装置中的${Fe_xO_y}$全部被还原,剩余固体为生成的铁的质量,戊装置中盛放的澄清石灰水吸收二氧化碳导致质量增加,增加的质量为二氧化碳的质量,根据化学方程式计算:${yCO + Fe_xO_y\xlongequal{\text{高温}}xFe + yCO_2}$
56x 44y
16.8g 17.6g
$\frac{16.8\,\text{g}}{17.6\,\text{g}}=\frac{56x}{44y}$ $\frac{x}{y}=\frac{3}{4}$,故该铁的氧化物是四氧化三铁,化学式为${Fe_3O_4}$。
(1)一氧化碳或CO
(2)${Fe_3O_4}$ [解析]
(1)丁装置盛放的是无水硫酸铜,无水硫酸铜遇水会变蓝,用于检验是否有水生成,丁装置没有明显变化,说明没有水生成,故该还原性气体不是氢气,戊装置盛放的是澄清石灰水,二氧化碳能使澄清石灰水变浑浊,用于检验是否有二氧化碳生成,戊装置中出现了白色沉淀,说明生成了二氧化碳,故该还原性气体是一氧化碳;
(2)丙装置中的${Fe_xO_y}$全部被还原,剩余固体为生成的铁的质量,戊装置中盛放的澄清石灰水吸收二氧化碳导致质量增加,增加的质量为二氧化碳的质量,根据化学方程式计算:${yCO + Fe_xO_y\xlongequal{\text{高温}}xFe + yCO_2}$
56x 44y
16.8g 17.6g
$\frac{16.8\,\text{g}}{17.6\,\text{g}}=\frac{56x}{44y}$ $\frac{x}{y}=\frac{3}{4}$,故该铁的氧化物是四氧化三铁,化学式为${Fe_3O_4}$。
查看更多完整答案,请扫码查看


