第42页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
7. 新情境 载人飞行器中的空气更新 已知某载人飞行器中的空气更新过程如图所示,下列说法不正确的是(
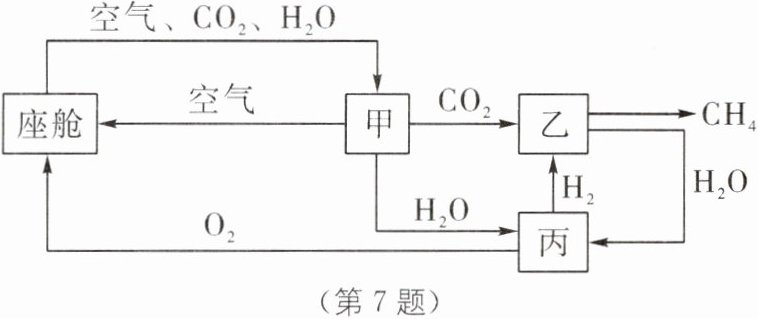
A.座舱中消耗氧气时发生的反应是放热反应
B.装置甲、乙、丙中都发生了化学变化
C.装置乙中 CO_2+4H_2$\frac{\underline{\;一定条件\;}}{}$CH_4+2H_2O,反应时缓缓通入气体可提高原料的利用率
D.装置甲、乙、丙主要将$ CO_2$和$ H_2O $转化为$ O_2,$在自然界实现该转化的途径是光合作用
B
)。
A.座舱中消耗氧气时发生的反应是放热反应
B.装置甲、乙、丙中都发生了化学变化
C.装置乙中 CO_2+4H_2$\frac{\underline{\;一定条件\;}}{}$CH_4+2H_2O,反应时缓缓通入气体可提高原料的利用率
D.装置甲、乙、丙主要将$ CO_2$和$ H_2O $转化为$ O_2,$在自然界实现该转化的途径是光合作用
答案:
B
8. (2024·苏州中考)捕集空气中$ CO_2$加氢制甲醇$(CH_3OH),$可实现$ CO_2$资源化利用和“零碳”排放,其转化流程图所示。下列说法不正确的是(
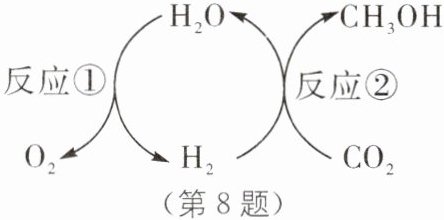
A.反应①中,电解水生成的$ H_2$和$ O_2$的分子个数比为 2∶1
B.反应②中,生产$ 1.6 kg CH_3OH $理论上要消耗$ 2.2 kg CO_2$
C.转化过程中$,H_2O $和$ H_2$循环转化,无需额外补充
D.等质量的甲醇制取时消耗的$ CO_2$与燃烧时生成的$ CO_2$相等,实现“零碳”排放
C
)。
A.反应①中,电解水生成的$ H_2$和$ O_2$的分子个数比为 2∶1
B.反应②中,生产$ 1.6 kg CH_3OH $理论上要消耗$ 2.2 kg CO_2$
C.转化过程中$,H_2O $和$ H_2$循环转化,无需额外补充
D.等质量的甲醇制取时消耗的$ CO_2$与燃烧时生成的$ CO_2$相等,实现“零碳”排放
答案:
C [解析]反应①水通电分解生成氢气和氧气,化学方程式为2H₂O$\frac{\underline{\;通电\;}}{\;}$2H₂↑+O₂↑,由化学方程式可知,电解水生成的H₂和O₂的分子个数比为2:1,A正确;反应②中,二氧化碳和氢气反应生成甲醇和水,根据碳元素质量守恒,则生产1.6 kg CH₃OH理论上要消耗CO₂的质量为(1.6 kg×$\frac{12}{12+4+16}$×100%)÷($\frac{12}{12+16×2}$×100%)=2.2 kg,B正确;反应①水通电分解生成氢气和氧气,化学方程式为2H₂O$\frac{\underline{\;通电\;}}{\;}$2H₂↑+O₂↑,反应②为二氧化碳和氢气反应生成甲醇和水,化学方程式为CO₂+3H₂$\frac{\underline{\;一定条件\;}}{\;}$CH₃OH+H₂O,总化学方程式为CO₂+H₂+H₂O$\frac{\underline{\;一定条件\;}}{\;}$CH₃OH+O₂,转化过程中,H₂O和H₂虽然可循环转化,但是也需额外补充,C错误;甲醇和氧气点燃生成二氧化碳和水,化学方程式为2CH₃OH+3O₂$\frac{\underline{\;点燃\;}}{\;}$2CO₂+4H₂O,二氧化碳和氢气反应生成甲醇和水,化学方程式为CO₂+3H₂$\frac{\underline{\;一定条件\;}}{\;}$CH₃OH+H₂O,由化学方程式可知,甲醇和二氧化碳的分子个数比均为1:1,故等质量的甲醇制取时消耗的CO₂与燃烧时生成的CO₂相等,可实现"零碳"排放,D正确。
9. 价类图是以元素化合价为纵坐标,物质类别为横坐标绘制的图像,它能将散乱的科学知识联系在一起,有助于对科学问题的理解和整体认知。如图是含碳元素物质的价类图,其中“→”表示物质间的转化关系。
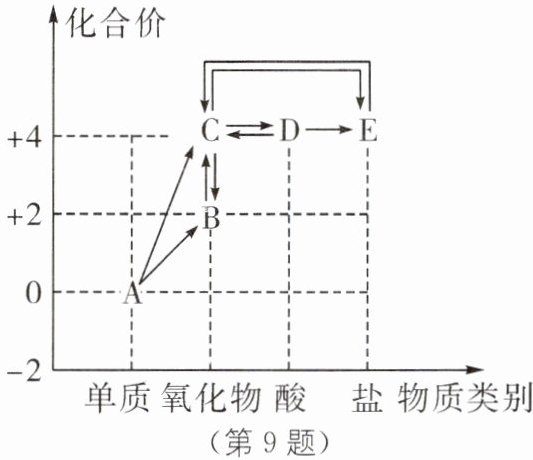
(1)写出物质 B 的化学式:
(2)写一个 C→E 的化学方程式:
(3)在图中物质相互转化关系中,反应类型有
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应

(1)写出物质 B 的化学式:
CO
.(2)写一个 C→E 的化学方程式:
CO₂+2NaOH=Na₂CO₃+H₂O
。(3)在图中物质相互转化关系中,反应类型有
ABCD
(填字母)。A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
答案:
(1)CO
(2)CO₂+2NaOH=Na₂CO₃+H₂O(合理即可)
(3)ABCD
[解析]
(1)由图可知,B是氧化物,且碳元素的化合价为+2,所以是CO。
(2)C是氧化物且碳元素的化合价为+4,所以是CO₂,E是含碳的盐,碳元素的化合价为+4,可能的化学方程式为2NaOH+CO₂=Na₂CO₃+H₂O。
(3)A是单质C,C是CO₂,碳在氧气中充分燃烧生成二氧化碳,属于化合反应,A正确;D是H₂CO₃,H₂CO₃不稳定,受热易分解成水和二氧化碳,即由D转化为C,属于分解反应,B正确;碳单质具有还原性,可以与氧化铜发生反应,生成铜和二氧化碳,即由A转化为C,属于置换反应,C正确;碳酸可以与氢氧化钠反应生成碳酸钠和水,即由D转化为E,属于复分解反应,D正确。
(1)CO
(2)CO₂+2NaOH=Na₂CO₃+H₂O(合理即可)
(3)ABCD
[解析]
(1)由图可知,B是氧化物,且碳元素的化合价为+2,所以是CO。
(2)C是氧化物且碳元素的化合价为+4,所以是CO₂,E是含碳的盐,碳元素的化合价为+4,可能的化学方程式为2NaOH+CO₂=Na₂CO₃+H₂O。
(3)A是单质C,C是CO₂,碳在氧气中充分燃烧生成二氧化碳,属于化合反应,A正确;D是H₂CO₃,H₂CO₃不稳定,受热易分解成水和二氧化碳,即由D转化为C,属于分解反应,B正确;碳单质具有还原性,可以与氧化铜发生反应,生成铜和二氧化碳,即由A转化为C,属于置换反应,C正确;碳酸可以与氢氧化钠反应生成碳酸钠和水,即由D转化为E,属于复分解反应,D正确。
10. A~F 均为科学中常见的物质,它们之间的关系如图所示(“→”表示转化关系,所涉及反应均为初中常见的化学反应),其中 A 俗称生石灰,C 是最常用的溶剂,C 与 F 的元素组成相同。
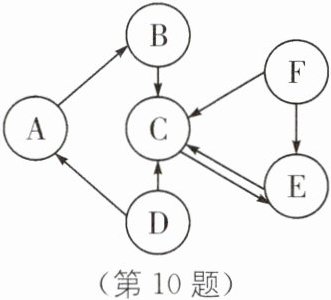
(1)C 的化学式是
(2)D 的一种用途是
(3)A→B 反应的基本类型是
(4)F→E 反应的化学方程式为

(1)C 的化学式是
H₂O
。(2)D 的一种用途是
作建筑材料(合理即可)
。(3)A→B 反应的基本类型是
化合反应
。(4)F→E 反应的化学方程式为
2H₂O₂$\frac{\underline{\;MnO₂\;}}{\;}$2H₂O+O₂↑
。
答案:
(1)H₂O
(2)作建筑材料(合理即可)
(3)化合反应
(4)2H₂O₂$\frac{\underline{\;MnO₂\;}}{\;}$2H₂O+O₂↑
(1)H₂O
(2)作建筑材料(合理即可)
(3)化合反应
(4)2H₂O₂$\frac{\underline{\;MnO₂\;}}{\;}$2H₂O+O₂↑
11. 已知 NaHCO_3在 270 ℃时完全分解为碳酸钠、水和二氧化碳,而 Na_2CO_3受热不分解。现有某工厂生产出的一批 NaHCO_3产品,其中混有少量的 Na_2CO_3,某兴趣小组同学为了测定该产品中 NaHCO_3的质量分数,设计了下列两种实验方案。
方案一:样品$\xrightarrow{稀硫酸}$测定生成 CO_2的质量。
(1)本实验采用如图所示的装置,C 中盛放的物质是
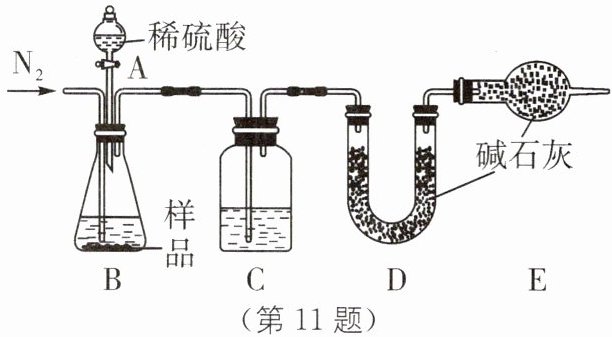
(2)若把分液漏斗中的稀硫酸改为稀盐酸,在其他操作正确的情况下,
方案二:样品$\xrightarrow{加热}$测定剩余固体的质量。
具体操作步骤:①取一只洁净的坩埚,称得质量为 21.2 g,再向其中加入样品,称得总质量为 41.2 g;②加热盛有样品的坩埚;③将坩埚充分冷却,称量坩埚和剩余固体的质量;④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为 35.0 g。
(3)实验时需要重复“加热、冷却、称量”操作多次,其目的是
(4)根据题意,计算样品中 NaHCO_3的质量分数,写出计算过程。(已知:2NaHCO_3$\xlongequal{\triangle}$Na_2CO_3+H_2O+CO_2↑)
解:实验过程中减少的质量是水和二氧化碳的质量,固体减少的质量为41.2 g-35.0 g=6.2 g,设NaHCO₃的质量为x,则NaHCO₃分解生成Na₂CO₃的质量为x-6.2 g。
2NaHCO₃$\frac{\underline{\;\triangle\;}}{\;}$Na₂CO₃+H₂O+CO₂↑
168 106
x x-6.2 g
$\frac{168}{106}$=$\frac{x}{x-6.2\;\text{g}}$ x=16.8 g
样品的质量=41.2 g-21.2 g=20 g,
NaHCO₃的质量分数=$\frac{16.8\;\text{g}}{20\;\text{g}}$×100%=84%,
答:样品中NaHCO₃的质量分数为84%。
方案一:样品$\xrightarrow{稀硫酸}$测定生成 CO_2的质量。
(1)本实验采用如图所示的装置,C 中盛放的物质是
浓硫酸
。
(2)若把分液漏斗中的稀硫酸改为稀盐酸,在其他操作正确的情况下,
不能
(填“能”或“不能”)准确测定样品中 NaHCO_3的质量分数。方案二:样品$\xrightarrow{加热}$测定剩余固体的质量。
具体操作步骤:①取一只洁净的坩埚,称得质量为 21.2 g,再向其中加入样品,称得总质量为 41.2 g;②加热盛有样品的坩埚;③将坩埚充分冷却,称量坩埚和剩余固体的质量;④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为 35.0 g。
(3)实验时需要重复“加热、冷却、称量”操作多次,其目的是
保证NaHCO₃全部分解
。(4)根据题意,计算样品中 NaHCO_3的质量分数,写出计算过程。(已知:2NaHCO_3$\xlongequal{\triangle}$Na_2CO_3+H_2O+CO_2↑)
解:实验过程中减少的质量是水和二氧化碳的质量,固体减少的质量为41.2 g-35.0 g=6.2 g,设NaHCO₃的质量为x,则NaHCO₃分解生成Na₂CO₃的质量为x-6.2 g。
2NaHCO₃$\frac{\underline{\;\triangle\;}}{\;}$Na₂CO₃+H₂O+CO₂↑
168 106
x x-6.2 g
$\frac{168}{106}$=$\frac{x}{x-6.2\;\text{g}}$ x=16.8 g
样品的质量=41.2 g-21.2 g=20 g,
NaHCO₃的质量分数=$\frac{16.8\;\text{g}}{20\;\text{g}}$×100%=84%,
答:样品中NaHCO₃的质量分数为84%。
答案:
(1)浓硫酸
(2)不能
(3)保证NaHCO₃全部分解
(4)解:实验过程中减少的质量是水和二氧化碳的质量,固体减少的质量为41.2 g-35.0 g=6.2 g,设NaHCO₃的质量为x,则NaHCO₃分解生成Na₂CO₃的质量为x-6.2 g。
2NaHCO₃$\frac{\underline{\;\triangle\;}}{\;}$Na₂CO₃+H₂O+CO₂↑
168 106
x x-6.2 g
$\frac{168}{106}$=$\frac{x}{x-6.2\;\text{g}}$ x=16.8 g
样品的质量=41.2 g-21.2 g=20 g,
NaHCO₃的质量分数=$\frac{16.8\;\text{g}}{20\;\text{g}}$×100%=84%,
答:样品中NaHCO₃的质量分数为84%。
(1)浓硫酸
(2)不能
(3)保证NaHCO₃全部分解
(4)解:实验过程中减少的质量是水和二氧化碳的质量,固体减少的质量为41.2 g-35.0 g=6.2 g,设NaHCO₃的质量为x,则NaHCO₃分解生成Na₂CO₃的质量为x-6.2 g。
2NaHCO₃$\frac{\underline{\;\triangle\;}}{\;}$Na₂CO₃+H₂O+CO₂↑
168 106
x x-6.2 g
$\frac{168}{106}$=$\frac{x}{x-6.2\;\text{g}}$ x=16.8 g
样品的质量=41.2 g-21.2 g=20 g,
NaHCO₃的质量分数=$\frac{16.8\;\text{g}}{20\;\text{g}}$×100%=84%,
答:样品中NaHCO₃的质量分数为84%。
查看更多完整答案,请扫码查看


