第49页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
10.(2024·滨州中考)小明和同学们在学习了工业炼铁的原理后,想通过自制一氧化碳模拟工业炼铁的化学原理。
【查阅资料】①二氧化碳和炭粉在高温的条件下生成一氧化碳;
②饱和碳酸氢钠溶液不与二氧化碳反应;
③饱和碳酸氢钠溶液能吸收氯化氢气体;
④一氧化碳既不与氢氧化钠溶液反应也不与澄清石灰水反应。
【设计并进行实验】同学们设计并进行了下图所示的实验(装置气密性良好)。
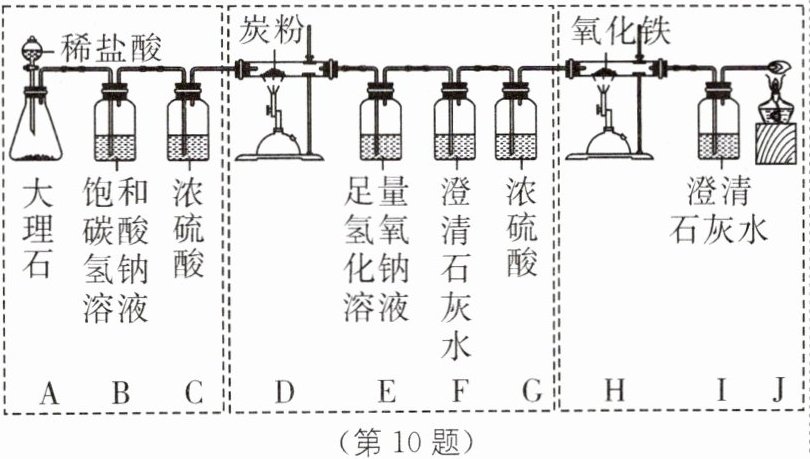
【实验分析】请结合实验回答下列问题:
(1)A 装置中发生反应的化学方程式为
(2)C 装置的作用是
(3)E 装置中发生反应的化学方程式为
(4)反应完毕,H 装置中玻璃管内观察到的现象是
(5)J 装置中点燃的酒精灯的作用是
【查阅资料】①二氧化碳和炭粉在高温的条件下生成一氧化碳;
②饱和碳酸氢钠溶液不与二氧化碳反应;
③饱和碳酸氢钠溶液能吸收氯化氢气体;
④一氧化碳既不与氢氧化钠溶液反应也不与澄清石灰水反应。
【设计并进行实验】同学们设计并进行了下图所示的实验(装置气密性良好)。

【实验分析】请结合实验回答下列问题:
(1)A 装置中发生反应的化学方程式为
CaCO₃+2HCl$\xlongequal{\;\;}$CaCl₂+H₂O+CO₂↑
。(2)C 装置的作用是
干燥二氧化碳气体
。(3)E 装置中发生反应的化学方程式为
CO₂+2NaOH$\xlongequal{\;\;}$Na₂CO₃+H₂O
。(4)反应完毕,H 装置中玻璃管内观察到的现象是
固体由红色变成黑色
,该反应的还原剂是 CO
(填化学式)。(5)J 装置中点燃的酒精灯的作用是
处理尾气,防止一氧化碳污染空气
。
答案:
(1)CaCO₃+2HCl$\xlongequal{\;\;}$CaCl₂+H₂O+CO₂↑
(2)干燥二氧化碳气体
(3)CO₂+2NaOH$\xlongequal{\;\;}$Na₂CO₃+H₂O
(4)固体由红色变成黑色 一氧化碳或CO
(5)处理尾气,防止一氧化碳污染空气 [解析]盐酸具有挥发性,A中产生的气体是二氧化碳、氯化氢和水蒸气,B装置中的碳酸氢钠能吸收氯化氢,浓硫酸具有吸水性且不与二氧化碳反应,C装置中浓硫酸能吸收水蒸气;D装置发生的反应是碳与二氧化碳在高温条件下生成一氧化碳,氢氧化钠与二氧化碳反应生成碳酸钠和水,E装置能吸收没有参加反应的二氧化碳,二氧化碳能与澄清石灰水中的氢氧化钙反应生成碳酸钙沉淀和水,F装置能检验二氧化碳是否完全除尽,G装置中浓硫酸能吸收水蒸气;H装置中一氧化碳与氧化铁在高温条件下生成铁和二氧化碳,二氧化碳能与澄清石灰水中的氢氧化钙反应生成碳酸钙沉淀和水,I装置能检验二氧化碳,一氧化碳具有可燃性,J装置用于处理尾气,防止一氧化碳污染空气。
(1)大理石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式是CaCO₃+2HCl$\xlongequal{\;\;}$CaCl₂+H₂O+CO₂↑;
(2)浓硫酸具有吸水性且不与二氧化碳反应,C装置的作用是干燥二氧化碳气体;
(3)E装置中发生的反应是氢氧化钠与二氧化碳反应生成碳酸钠和水,反应的化学方程式为CO₂+2NaOH$\xlongequal{\;\;}$Na₂CO₃+H₂O;
(4)H装置中一氧化碳与氧化铁在高温条件下生成铁和二氧化碳,反应完全后,H装置中玻璃管内观察到的现象是固体由红色变成黑色;该反应中一氧化碳得到氧元素,还原剂是一氧化碳(或CO);
(5)J装置中点燃的酒精灯的作用是处理尾气,防止一氧化碳污染空气。
(1)CaCO₃+2HCl$\xlongequal{\;\;}$CaCl₂+H₂O+CO₂↑
(2)干燥二氧化碳气体
(3)CO₂+2NaOH$\xlongequal{\;\;}$Na₂CO₃+H₂O
(4)固体由红色变成黑色 一氧化碳或CO
(5)处理尾气,防止一氧化碳污染空气 [解析]盐酸具有挥发性,A中产生的气体是二氧化碳、氯化氢和水蒸气,B装置中的碳酸氢钠能吸收氯化氢,浓硫酸具有吸水性且不与二氧化碳反应,C装置中浓硫酸能吸收水蒸气;D装置发生的反应是碳与二氧化碳在高温条件下生成一氧化碳,氢氧化钠与二氧化碳反应生成碳酸钠和水,E装置能吸收没有参加反应的二氧化碳,二氧化碳能与澄清石灰水中的氢氧化钙反应生成碳酸钙沉淀和水,F装置能检验二氧化碳是否完全除尽,G装置中浓硫酸能吸收水蒸气;H装置中一氧化碳与氧化铁在高温条件下生成铁和二氧化碳,二氧化碳能与澄清石灰水中的氢氧化钙反应生成碳酸钙沉淀和水,I装置能检验二氧化碳,一氧化碳具有可燃性,J装置用于处理尾气,防止一氧化碳污染空气。
(1)大理石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式是CaCO₃+2HCl$\xlongequal{\;\;}$CaCl₂+H₂O+CO₂↑;
(2)浓硫酸具有吸水性且不与二氧化碳反应,C装置的作用是干燥二氧化碳气体;
(3)E装置中发生的反应是氢氧化钠与二氧化碳反应生成碳酸钠和水,反应的化学方程式为CO₂+2NaOH$\xlongequal{\;\;}$Na₂CO₃+H₂O;
(4)H装置中一氧化碳与氧化铁在高温条件下生成铁和二氧化碳,反应完全后,H装置中玻璃管内观察到的现象是固体由红色变成黑色;该反应中一氧化碳得到氧元素,还原剂是一氧化碳(或CO);
(5)J装置中点燃的酒精灯的作用是处理尾气,防止一氧化碳污染空气。
11. 中考新考法 《天工开物》 (2024·山西中考)我国是世界上锌冶炼最早的国家。明代宋应星所著的《天工开物》中有关"火法"炼锌的工艺记载是"每炉甘石(主要成分是碳酸锌)十斤装载入一泥罐内……然后逐层用煤炭饼(反应后生成一氧化碳)垫盛,其底铺薪,发火煅红……冷定毁罐取出……即倭铅(锌)也。"此工艺过程分解模拟如图。(已知:Zn 的冶炼温度为 904℃,Zn 的沸点为 906℃。)请结合图文信息,分析思考,解决问题:
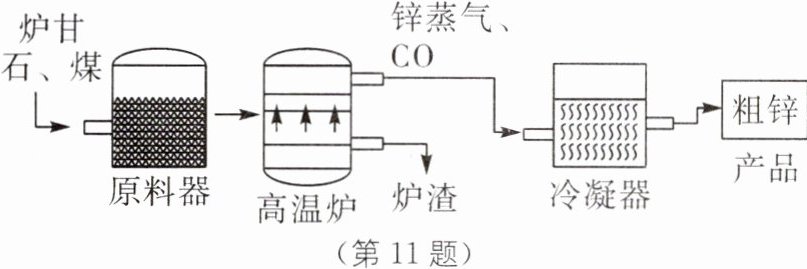
(1)装入原料器之前,将炉甘石敲碎的目的是
(2)高温炉内,碳酸锌$(ZnCO_3)$在高温条件下与煤的主要成分发生反应生成 Zn 和 CO,反应的化学方程式为
(3)冷凝器中发生的变化属于
(4)我国古代冶锌晚于铁和铜,结合已知信息,分析说明其中的原因是

(1)装入原料器之前,将炉甘石敲碎的目的是
增大反应物的接触面积,使反应更充分
。(2)高温炉内,碳酸锌$(ZnCO_3)$在高温条件下与煤的主要成分发生反应生成 Zn 和 CO,反应的化学方程式为
2C+ZnCO₃$\xlongequal{高温}$Zn+3CO↑
。该反应生成物中碳元素的化合价为 +2
。(3)冷凝器中发生的变化属于
物理变化
(填"物理变化"或"化学变化")。(4)我国古代冶锌晚于铁和铜,结合已知信息,分析说明其中的原因是
锌的金属活动性比铁和铜强
。
答案:
(1)增大反应物的接触面积,使反应更充分
(2)2C+ZnCO₃$\xlongequal{高温}$Zn+3CO↑ +2
(3)物理变化
(4)锌的金属活动性比铁和铜强 [解析]
(1)将炉甘石敲碎可以增大反应物之间的接触面积,使反应更充分;
(2)碳酸锌(ZnCO₃)在高温条件下与煤的主要成分(C)发生反应生成Zn和CO,反应的化学方程式为2C+ZnCO₃$\xlongequal{高温}$Zn+3CO↑;该反应生成物中氧元素化合价为-2,根据化合物中各元素正负化合价代数和为0,可知CO中碳元素的化合价为+2;
(3)锌蒸气在冷凝器中只是物质状态改变,没有生成新物质,属于物理变化;
(4)锌的金属活动性比铁和铜强,容易与氧气反应生成锌的化合物,故我国古代冶锌晚于铁和铜。
(1)增大反应物的接触面积,使反应更充分
(2)2C+ZnCO₃$\xlongequal{高温}$Zn+3CO↑ +2
(3)物理变化
(4)锌的金属活动性比铁和铜强 [解析]
(1)将炉甘石敲碎可以增大反应物之间的接触面积,使反应更充分;
(2)碳酸锌(ZnCO₃)在高温条件下与煤的主要成分(C)发生反应生成Zn和CO,反应的化学方程式为2C+ZnCO₃$\xlongequal{高温}$Zn+3CO↑;该反应生成物中氧元素化合价为-2,根据化合物中各元素正负化合价代数和为0,可知CO中碳元素的化合价为+2;
(3)锌蒸气在冷凝器中只是物质状态改变,没有生成新物质,属于物理变化;
(4)锌的金属活动性比铁和铜强,容易与氧气反应生成锌的化合物,故我国古代冶锌晚于铁和铜。
查看更多完整答案,请扫码查看


