2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版A山东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版A山东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第78页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
1. 下列叙述正确的是(
A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其 $c(H^{+})· c(OH^{-})=1×10^{-14}$
B.$c(H^{+})=1×10^{-7}mol· L^{-1}$ 的溶液一定是中性溶液
C.$0.2mol· L^{-1}CH_{3}COOH$ 溶液中的 $c(H^{+})$ 是 $0.1mol· L^{-1}CH_{3}COOH$ 溶液中的 $c(H^{+})$ 的 2 倍
D.任何浓度的溶液都可以用 pH 来表示其酸性的强弱
A
)。A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其 $c(H^{+})· c(OH^{-})=1×10^{-14}$
B.$c(H^{+})=1×10^{-7}mol· L^{-1}$ 的溶液一定是中性溶液
C.$0.2mol· L^{-1}CH_{3}COOH$ 溶液中的 $c(H^{+})$ 是 $0.1mol· L^{-1}CH_{3}COOH$ 溶液中的 $c(H^{+})$ 的 2 倍
D.任何浓度的溶液都可以用 pH 来表示其酸性的强弱
答案:
A 解析: $K_w=c(H^+)· c(OH^-)$,且$K_w$只与温度有关,所以,在常温下,纯水,酸性、碱性或中性稀溶液,其$K_w=1×10^{-14}$;在温度不确定时,中性溶液里的$c(H^+)$不一定等于$1×10^{-7}mol· L^{-1}$;常温下,$0.2mol· L^{-1}CH_3COOH$溶液中的$CH_3COOH$电离程度比$0.1mol· L^{-1}CH_3COOH$溶液中的$CH_3COOH$电离程度小,所以,$0.2mol· L^{-1}CH_3COOH$溶液中的$c(H^+)$小于$0.1mol· L^{-1}CH_3COOH$溶液中的$c(H^+)$的2倍;当$c(H^+)$或$c(OH^-)$大于$1mol· L^{-1}$时,用pH表示溶液的酸碱性就不简便了,所以,当$c(H^+)$或$c(OH^-)$大于$1mol· L^{-1}$时,一般不用pH表示溶液的酸碱性,而是直接用$c(H^+)$或$c(OH^-)$来表示。
2. (双选)一定温度下,用水稀释 $0.1mol· L^{-1}$ 的一元弱酸 HA,随着稀释的进行,下列数值一定增大的是(
A.$K_{w}$
B.$\frac{c(H^{+})}{K_{a}}$
C.$\frac{c(A^{-})}{c(HA)}$
D.$c(OH^{-})$
CD
)。A.$K_{w}$
B.$\frac{c(H^{+})}{K_{a}}$
C.$\frac{c(A^{-})}{c(HA)}$
D.$c(OH^{-})$
答案:
CD 解析: 温度不变,$K_w$不变,A项不符合题意;根据$K_a=\frac{c(H^+)· c(A^-)}{c(HA)}$,推出$\frac{c(H^+)}{c(HA)}=\frac{n(HA)}{n(A^-)}$,加水稀释时,HA电离程度增大,$n(HA)$减小,$n(A^-)$增大,则$\frac{c(HA)}{c(A^-)}$减小,$\frac{c(H^+)}{K_a}$减小,$\frac{c(A^-)}{c(HA)}$增大,B项不符合题意,C项符合题意;加水稀释 HA电离程度增大,但是$c(H^+)$减小,因$K_w$不变,可知$c(OH^-)$增大,D项符合题意。
3. (双选)如图表示水中 $c(H^{+})$ 和 $c(OH^{-})$ 的关系,下列判断错误的是(
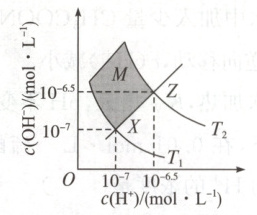
A.两条曲线间任意点均有 $c(H^{+})· c(OH^{-})=K_{w}$
B.M 区域内任意点均有 $c(H^{+})>c(OH^{-})$
C.图中 $T_{1}<T_{2}$
D.XZ 线上任意点均有 $pH = 7$
BD
)。
A.两条曲线间任意点均有 $c(H^{+})· c(OH^{-})=K_{w}$
B.M 区域内任意点均有 $c(H^{+})>c(OH^{-})$
C.图中 $T_{1}<T_{2}$
D.XZ 线上任意点均有 $pH = 7$
答案:
BD 解析: 任何水溶液中都有$K_w=c(H^+)· c(OH^-)$,因此两条曲线间任一点均有此关系,A项正确;$XZ$线上任意点溶液呈中性,M区域在$XZ$上方,均有$c(H^+)<c(OH^-)$,B项错误;$T_1$时$K_w$小于$T_2$时$K_w$,则$T_1<T_2$,C项正确;$XZ$线上任意点溶液呈中性,但只有在$25° C$时pH=7,D项错误。
4. $25^{\circ}C$ 时,下列四种溶液中,由水电离出的 $c(H^{+})$ 之比是(
①$1mol· L^{-1}$ 的盐酸 ②$0.1mol· L^{-1}$ 的盐酸 ③$0.01mol· L^{-1}$ 的 NaOH 溶液 ④$1mol· L^{-1}$ 的 NaOH 溶液
A.$1:10:100:1$
B.$1:10^{-1}:10^{-12}:10^{-14}$
C.$14:13:12:14$
D.$14:13:2:1$
A
)。①$1mol· L^{-1}$ 的盐酸 ②$0.1mol· L^{-1}$ 的盐酸 ③$0.01mol· L^{-1}$ 的 NaOH 溶液 ④$1mol· L^{-1}$ 的 NaOH 溶液
A.$1:10:100:1$
B.$1:10^{-1}:10^{-12}:10^{-14}$
C.$14:13:12:14$
D.$14:13:2:1$
答案:
A 解析: $25° C$时,$K_w=1.0×10^{-14}$,酸溶液中由水电离出的$c(H^+)$等于该溶液中由水电离出的$c(OH^-)$,①中,$c(H^+)=1mol· L^{-1}$,由水电离出的$c(H^+)=1.0×10^{-14}mol· L^{-1}$;②中,$c(H^+)=0.1mol· L^{-1}$,则由水电离出的$c(H^+)=1.0×10^{-13}mol· L^{-1}$;③中,$c(OH^-)=0.01mol· L^{-1}$,水电离出的$c(H^+)=1.0×10^{-12}mol· L^{-1}$;④中,由水电离出的$c(H^+)=1.0×10^{-14}mol· L^{-1}$。四种溶液中由水电离出的$c(H^+)$之比为$10^{-14}:10^{-13}:10^{-12}:10^{-14}=1:10:100:1$。
5. 已知 $t^{\circ}C$ 时,$0.01mol· L^{-1}NaOH$ 溶液的 $pH = 11$,$0.1mol· L^{-1}$ 的 HA 溶液中 $\frac{c(H^{+})}{c(OH^{-})}=10^{9}$。请回答下列问题。
(1) 该温度下,水的离子积 $K_{w}=$
(2) $0.1mol· L^{-1}$ 的 HA 溶液中水电离出的 $c(OH^{-})=$
(1) 该温度下,水的离子积 $K_{w}=$
$1×10^{-13}$
。(2) $0.1mol· L^{-1}$ 的 HA 溶液中水电离出的 $c(OH^{-})=$
$1×10^{-11}mol· L^{-1}$
。
答案:
(1)$1×10^{-13}$
(2)$1×10^{-11}mol· L^{-1}$
(1)$1×10^{-13}$
(2)$1×10^{-11}mol· L^{-1}$
一、测定和调控 pH 的意义
1. 医疗保健:当体内的酸碱平衡失调时,可以利用
2. 日常生活:人们洗发时使用的
3. 环保领域:酸性废水可通过投加
4. 农业生产:控制土壤的 pH 使之适宜作物生长,提高作物的质量和产量。
5. 在科学实验和工业生产方面:溶液 pH 的控制常常是影响实验
6. 在酸碱中和滴定中,溶液 pH 的突变是判断
1. 医疗保健:当体内的酸碱平衡失调时,可以利用
药物
_ 调节和控制 pH 辅助治疗。2. 日常生活:人们洗发时使用的
护发素
_ 具有调节头发的 pH 使之达到适宜酸碱度的功能。3. 环保领域:酸性废水可通过投加
碱性
_ 废渣或通过碱性
_ 滤料层过滤使之中和;碱性废水可通过投加酸性
_ 废水或利用烟道气
_ 中和,在中和过程中可用 pH 自动测定仪进行检测和控制。4. 农业生产:控制土壤的 pH 使之适宜作物生长,提高作物的质量和产量。
5. 在科学实验和工业生产方面:溶液 pH 的控制常常是影响实验
结果
_ 或产品质量、产量
_ 的一个重要因素。6. 在酸碱中和滴定中,溶液 pH 的突变是判断
滴定终点
_ 的依据。
答案:
1.药物 2.护发素 3.碱性 碱性 酸性 烟道气 5.结果 质量、产量 6.滴定终点
查看更多完整答案,请扫码查看


