2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版A山东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版A山东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第29页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
1. (双选)在一定温度下,$100mL6mol· L^{-1}$的硫酸与过量锌粉反应,为了减小反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的(
A.硫酸钠固体
B.水
C.硫酸钾溶液
D.硝酸钾溶液
BC
)。A.硫酸钠固体
B.水
C.硫酸钾溶液
D.硝酸钾溶液
答案:
BC解析加入水或硫酸钾溶液都可减小溶液中$\mathrm{H}^+$的浓度,但不影响$\mathrm{H}^+$的物质的量,所以能减小反应速率,且不影响生成氢气的总量。加入硝酸钾溶液,引入$\mathrm{NO}_3^-$,酸性条件下$\mathrm{NO}_3^-$与锌反应不生成氢气。加入硫酸钠固体对反应速率无影响。
2. 把下列$4$种$X$的溶液分别加入$4$个盛有$10mL2mol· L^{-1}$盐酸的烧杯中,均加水稀释到$50mL$,此时$X$与盐酸缓慢地进行反应。其中反应速率最大的是(
A.$20mL3mol· L^{-1}$的$X$溶液
B.$20mL2mol· L^{-1}$的$X$溶液
C.$10mL4mol· L^{-1}$的$X$溶液
D.$10mL2mol· L^{-1}$的$X$溶液
A
)。A.$20mL3mol· L^{-1}$的$X$溶液
B.$20mL2mol· L^{-1}$的$X$溶液
C.$10mL4mol· L^{-1}$的$X$溶液
D.$10mL2mol· L^{-1}$的$X$溶液
答案:
A解析最后均加水稀释到50mL,所以要比较加入的X的物质的量。将四个选项中X溶液的体积与浓度相乘,求出X的物质的量,经过比较,可知A项中X的物质的量最大,加水稀释到50mL时其浓度最大,反应速率最大。
3. (双选)在一定温度下,$10mL0.40mol· L^{-1}H_{2}O_{2}$溶液发生催化分解。不同时刻测得生成$O_{2}$的体积(已折算为标准状况)如下表:
下列叙述不正确的是(溶液体积变化忽略不计)(

A.$0\sim6min$的平均反应速率:$v(H_{2}O_{2})\approx3.3×10^{-2}mol· L^{-1}· min^{-1}$
B.$6\sim10min$的平均反应速率:$v(H_{2}O_{2})>3.3×10^{-2}mol· L^{-1}· min^{-1}$
C.反应至$6min$时,$c(H_{2}O_{2}) = 0.30mol· L^{-1}$
D.反应至$6min$时,$H_{2}O_{2}$分解了$50\%$
下列叙述不正确的是(溶液体积变化忽略不计)(
BC
)。
A.$0\sim6min$的平均反应速率:$v(H_{2}O_{2})\approx3.3×10^{-2}mol· L^{-1}· min^{-1}$
B.$6\sim10min$的平均反应速率:$v(H_{2}O_{2})>3.3×10^{-2}mol· L^{-1}· min^{-1}$
C.反应至$6min$时,$c(H_{2}O_{2}) = 0.30mol· L^{-1}$
D.反应至$6min$时,$H_{2}O_{2}$分解了$50\%$
答案:
BC解析10mL溶液中含有$\mathrm{H}_2\mathrm{O}_2$的物质的量为$0.01\mathrm{L}×0.4\mathrm{mol· L^{-1}} = 0.004\mathrm{mol}$,
6min时,氧气的物质的量为$\frac{0.0224\mathrm{L}}{22.4\mathrm{L· mol^{-1}}}=$
$0.001\mathrm{mol}$,根据$2\mathrm{H}_2\mathrm{O}_2\xrightarrow{催化剂}2\mathrm{H}_2\mathrm{O}+\mathrm{O}_2\uparrow$可知,0~6min内,
$\Delta c(\mathrm{H}_2\mathrm{O}_2)=-\frac{0.002\mathrm{mol}}{0.01\mathrm{L}}=-0.2\mathrm{mol· L^{-1}}$,
$v(\mathrm{H}_2\mathrm{O}_2)=-\frac{\Delta c(\mathrm{H}_2\mathrm{O}_2)}{\Delta t}=\frac{0.2\mathrm{mol· L^{-1}}}{6\mathrm{min}}\approx3.3×$
$10^{-2}\mathrm{mol· L^{-1}· min^{-1}}$,A项正确。随着反应的进行,$\mathrm{H}_2\mathrm{O}_2$的浓度逐渐减小,反应速率也逐渐减
小,所以6~10min的平均反应速率小于前6min
的平均速率,即小于$3.3×10^{-2}\mathrm{mol· L^{-1}· min^{-1}}$,
B项错误。6min时,$c(\mathrm{H}_2\mathrm{O}_2)=0.4\mathrm{mol· L^{-1}} -$
$0.2\mathrm{mol· L^{-1}} = 0.2\mathrm{mol· L^{-1}}$,$\mathrm{H}_2\mathrm{O}_2$分解率为
50%,C项错误、D项正确。
6min时,氧气的物质的量为$\frac{0.0224\mathrm{L}}{22.4\mathrm{L· mol^{-1}}}=$
$0.001\mathrm{mol}$,根据$2\mathrm{H}_2\mathrm{O}_2\xrightarrow{催化剂}2\mathrm{H}_2\mathrm{O}+\mathrm{O}_2\uparrow$可知,0~6min内,
$\Delta c(\mathrm{H}_2\mathrm{O}_2)=-\frac{0.002\mathrm{mol}}{0.01\mathrm{L}}=-0.2\mathrm{mol· L^{-1}}$,
$v(\mathrm{H}_2\mathrm{O}_2)=-\frac{\Delta c(\mathrm{H}_2\mathrm{O}_2)}{\Delta t}=\frac{0.2\mathrm{mol· L^{-1}}}{6\mathrm{min}}\approx3.3×$
$10^{-2}\mathrm{mol· L^{-1}· min^{-1}}$,A项正确。随着反应的进行,$\mathrm{H}_2\mathrm{O}_2$的浓度逐渐减小,反应速率也逐渐减
小,所以6~10min的平均反应速率小于前6min
的平均速率,即小于$3.3×10^{-2}\mathrm{mol· L^{-1}· min^{-1}}$,
B项错误。6min时,$c(\mathrm{H}_2\mathrm{O}_2)=0.4\mathrm{mol· L^{-1}} -$
$0.2\mathrm{mol· L^{-1}} = 0.2\mathrm{mol· L^{-1}}$,$\mathrm{H}_2\mathrm{O}_2$分解率为
50%,C项错误、D项正确。
4. 有一化学反应:$aA + bB = C$,根据影响化学反应速率的因素可得$v(C) = k· c^{m}(A)· c^{n}(B)$,其中$k$是与温度有关的常数,为测$k$、$m$、$n$的值,在$25^{\circ}C$时,将$A$、$B$溶液按不同浓度混合,得到下列实验数据:
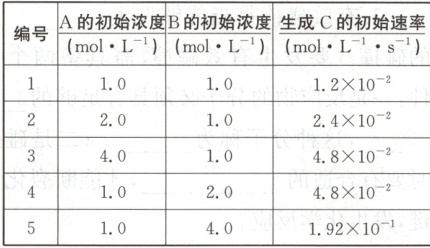
(1)根据上表可求得:$m=$
(2)已知$a = m$,$b = n$,当$c(A) = c(B) = 2.0mol· L^{-1}$时,求以$B$表示的初始反应速率。

(1)根据上表可求得:$m=$
$1$
,$n=$$2$
,$k=$$1.2×10^{-2}\mathrm{L}^2·\mathrm{mol}^{-2}·\mathrm{s}^{-1}$
,$k$的单位是$\mathrm{L}^2·\mathrm{mol}^{-2}·\mathrm{s}^{-1}$
。(2)已知$a = m$,$b = n$,当$c(A) = c(B) = 2.0mol· L^{-1}$时,求以$B$表示的初始反应速率。
答案:
(1)1 2 $1.2×10^{-2}\mathrm{L}^2·\mathrm{mol}^{-2}·\mathrm{s}^{-1}$ $\mathrm{L}^2·\mathrm{mol}^{-2}·\mathrm{s}^{-1}$
(2)$v(\mathrm{B})=0.192\mathrm{mol· L^{-1}· s^{-1}}$
解析
(1)用B的初始浓度数据相同,A的初始浓度数据成倍数关系的两组,如选编号为1、2的两组,即可求出$m = 1$。同样方法,如选编号为1、4的
两组,求出$n = 2$。将$m = 1$、$n = 2$代入其中一组数据(如选编号为1的组)即可求出
$k = 1.2×10^{-2}\mathrm{L}^2·\mathrm{mol}^{-2}·\mathrm{s}^{-1}$。
(2)以C表示的初始反应速率$v(\mathrm{C}) = 1.2×$
$10^{-2}\mathrm{L}^2·\mathrm{mol}^{-2}·\mathrm{s}^{-1}×20\mathrm{mol· L^{-1}}×(20\mathrm{mol· L^{-1}})^2=$
$9.6×10^{-2}\mathrm{mol· L^{-1}· s^{-1}}$,$v(\mathrm{B}) = 2v(\mathrm{C}) =$
$2×9.6×10^{-2}\mathrm{mol· L^{-1}· s^{-1}} = 0.192\mathrm{mol· L^{-1}· s^{-1}}$。
(1)1 2 $1.2×10^{-2}\mathrm{L}^2·\mathrm{mol}^{-2}·\mathrm{s}^{-1}$ $\mathrm{L}^2·\mathrm{mol}^{-2}·\mathrm{s}^{-1}$
(2)$v(\mathrm{B})=0.192\mathrm{mol· L^{-1}· s^{-1}}$
解析
(1)用B的初始浓度数据相同,A的初始浓度数据成倍数关系的两组,如选编号为1、2的两组,即可求出$m = 1$。同样方法,如选编号为1、4的
两组,求出$n = 2$。将$m = 1$、$n = 2$代入其中一组数据(如选编号为1的组)即可求出
$k = 1.2×10^{-2}\mathrm{L}^2·\mathrm{mol}^{-2}·\mathrm{s}^{-1}$。
(2)以C表示的初始反应速率$v(\mathrm{C}) = 1.2×$
$10^{-2}\mathrm{L}^2·\mathrm{mol}^{-2}·\mathrm{s}^{-1}×20\mathrm{mol· L^{-1}}×(20\mathrm{mol· L^{-1}})^2=$
$9.6×10^{-2}\mathrm{mol· L^{-1}· s^{-1}}$,$v(\mathrm{B}) = 2v(\mathrm{C}) =$
$2×9.6×10^{-2}\mathrm{mol· L^{-1}· s^{-1}} = 0.192\mathrm{mol· L^{-1}· s^{-1}}$。
查看更多完整答案,请扫码查看


