2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第9页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
盖斯定律
1.内容
不管化学反应是一步完成或分几步完成,其反应热是________的。
1.内容
不管化学反应是一步完成或分几步完成,其反应热是________的。
答案:
相同
2.特点
(1)反应的热效应只与始态、终态有关,与反应的________无关。
(2)反应热总值一定,如图表示始态到终态的反应热。

则ΔH = ______________
= ______________。
(3)能量守恒:能量既不会增加,也不会减少,只会从一种形式转化为另一种形式。
(1)反应的热效应只与始态、终态有关,与反应的________无关。
(2)反应热总值一定,如图表示始态到终态的反应热。

则ΔH = ______________
= ______________。
(3)能量守恒:能量既不会增加,也不会减少,只会从一种形式转化为另一种形式。
答案:
(1)途径
(2)$\Delta H_{1}+\Delta H_{2}$ $\Delta H_{3}+\Delta H_{4}+\Delta H_{5}$
(1)途径
(2)$\Delta H_{1}+\Delta H_{2}$ $\Delta H_{3}+\Delta H_{4}+\Delta H_{5}$
4.应用盖斯定律的计算
根据如下两个反应,计算出C(s)+$\frac{1}{2}$O2(g)=CO(g)的反应热ΔH。
Ⅰ.C(s)+O2(g)=CO2(g)
ΔH1 = -393.5 kJ·mol-1
Ⅱ.CO(g)+$\frac{1}{2}$O2(g)=CO2(g)
ΔH2 = -283.0 kJ·mol-1
(1)“虚拟路径”法
反应C(s)+O2(g)=CO2(g)的途径可设计如下:
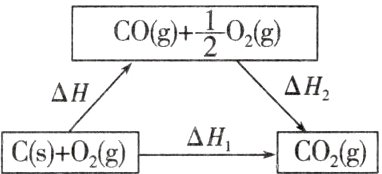
则ΔH = ______________ = ______________kJ·mol-1。
(2)加合法
找唯一:C、CO分别在Ⅰ、Ⅱ中出现一次
同侧加:C是Ⅰ中反应物,为同侧,则“+Ⅰ”
异侧减:CO是Ⅱ中反应物,为异侧,则“-Ⅱ”
调计量数:化学计量数相同,不用调整,则Ⅰ - Ⅱ即为运算式。所以ΔH = ______________ = ______________kJ·mol-1。
根据如下两个反应,计算出C(s)+$\frac{1}{2}$O2(g)=CO(g)的反应热ΔH。
Ⅰ.C(s)+O2(g)=CO2(g)
ΔH1 = -393.5 kJ·mol-1
Ⅱ.CO(g)+$\frac{1}{2}$O2(g)=CO2(g)
ΔH2 = -283.0 kJ·mol-1
(1)“虚拟路径”法
反应C(s)+O2(g)=CO2(g)的途径可设计如下:

则ΔH = ______________ = ______________kJ·mol-1。
(2)加合法
找唯一:C、CO分别在Ⅰ、Ⅱ中出现一次
同侧加:C是Ⅰ中反应物,为同侧,则“+Ⅰ”
异侧减:CO是Ⅱ中反应物,为异侧,则“-Ⅱ”
调计量数:化学计量数相同,不用调整,则Ⅰ - Ⅱ即为运算式。所以ΔH = ______________ = ______________kJ·mol-1。
答案:
−110.5
(2) −110.5
(2) −110.5
[判一判]
(1)一个反应一步完成或分几步完成,两者相比,经过的步骤越多,放出的热量越多 ( )
(2)所有化学反应的反应热都可以通过实验测定 ( )
(3)在 中,存在关系式:ΔH1 = ΔH2 +ΔH3 ( )
中,存在关系式:ΔH1 = ΔH2 +ΔH3 ( )
(1)一个反应一步完成或分几步完成,两者相比,经过的步骤越多,放出的热量越多 ( )
(2)所有化学反应的反应热都可以通过实验测定 ( )
(3)在
 中,存在关系式:ΔH1 = ΔH2 +ΔH3 ( )
中,存在关系式:ΔH1 = ΔH2 +ΔH3 ( )
答案:
(1)×
(2)×
(3)×
(1)×
(2)×
(3)×
二、反应热的计算
1.主要依据
热化学方程式、键能、盖斯定律及燃烧热等数据。
2.主要方法
(1)依据热化学方程式:反应热的绝对值与各物质的物质的量成正比,依据热化学方程式中的ΔH求反应热,如

则$\frac{n(A)}{a}$=$\frac{n(B)}{b}$=$\frac{n(C)}{c}$=$\frac{n(D)}{d}$=________。
(2)依据盖斯定律:根据盖斯定律,可以将两个或两个以上的热化学方程式包括其ΔH相加或相减,得到一个新的热化学方程式,同时反应热也作相应的改变。
(3)依据反应物断键吸收热量Q吸与生成物成键放出热量Q放进行计算:ΔH = ______________。
(4)根据图像计算

(5)依据物质的燃烧热ΔH计算:Q放 = ______________。
(6)依据比热公式计算:Q = ______________。
1.主要依据
热化学方程式、键能、盖斯定律及燃烧热等数据。
2.主要方法
(1)依据热化学方程式:反应热的绝对值与各物质的物质的量成正比,依据热化学方程式中的ΔH求反应热,如

则$\frac{n(A)}{a}$=$\frac{n(B)}{b}$=$\frac{n(C)}{c}$=$\frac{n(D)}{d}$=________。
(2)依据盖斯定律:根据盖斯定律,可以将两个或两个以上的热化学方程式包括其ΔH相加或相减,得到一个新的热化学方程式,同时反应热也作相应的改变。
(3)依据反应物断键吸收热量Q吸与生成物成键放出热量Q放进行计算:ΔH = ______________。
(4)根据图像计算

(5)依据物质的燃烧热ΔH计算:Q放 = ______________。
(6)依据比热公式计算:Q = ______________。
答案:
(1)$\frac{|Q|}{|\Delta H|}$
(3)$Q_{吸}-Q_{放}$
(5)$n_{可燃物}\times|\Delta H|$
(6)$cm\Delta t$
(1)$\frac{|Q|}{|\Delta H|}$
(3)$Q_{吸}-Q_{放}$
(5)$n_{可燃物}\times|\Delta H|$
(6)$cm\Delta t$
ΔH的大小比较
1.同一物质不同聚集状态
H2O(s)=H2O(l) ΔH1
H2O(s)=H2O(g) ΔH2

由物质的能量E大小比较知热量:Q1________Q2,且均为吸热反应,ΔH为正值,ΔH1 = Q1 kJ·mol-1,ΔH2 = Q2 kJ·mol-1,得ΔH1________ΔH2。
1.同一物质不同聚集状态
H2O(s)=H2O(l) ΔH1
H2O(s)=H2O(g) ΔH2

由物质的能量E大小比较知热量:Q1________Q2,且均为吸热反应,ΔH为正值,ΔH1 = Q1 kJ·mol-1,ΔH2 = Q2 kJ·mol-1,得ΔH1________ΔH2。
答案:
< <
2.同一反应,物质的聚集状态不同
S(g)+O2(g)=SO2(g) ΔH1
S(s)+O2(g)=SO2(g) ΔH2

由物质的能量(E)的大小知热量:Q1________Q2,此反应为放热反应,则ΔH1 = -Q1 kJ·mol-1,ΔH2 = -Q2 kJ·mol-1得ΔH1________ΔH2。
S(g)+O2(g)=SO2(g) ΔH1
S(s)+O2(g)=SO2(g) ΔH2

由物质的能量(E)的大小知热量:Q1________Q2,此反应为放热反应,则ΔH1 = -Q1 kJ·mol-1,ΔH2 = -Q2 kJ·mol-1得ΔH1________ΔH2。
答案:
> <
查看更多完整答案,请扫码查看


